Правила и рекомендации по эксплуатации элементов питания
Для того, чтобы элементы питания (ЭП) прослужили Вам максимально возможный срок, а также чтобы устройства, с которыми они работают, радовали Вас своей безотказной работой, советуем придерживаться следующих несложных правил и рекомендаций:
Избегайте механических повреждений и теплового воздействия на элементы питания
При деформации корпуса и сильном нагреве внутренние компоненты батареи вступают в непредусмотренную конструктивом реакцию, в результате которой бурно выделяется газообразная субстанция. Газы оказывают чрезмерное давление на всю внутреннюю поверхность цилиндра гальванического элемента. Такая ситуация приводит к разрушению корпуса, протечке электролита или взрыву, что вполне может нанести ущерб здоровью пользователя или используемой им технике.
Соблюдение же разумных правил и режима работы, аккуратное обращение с элементом питания, предотвращение чрезмерного нагрева (выше 50°С) его поверхности — в таком случае эксплуатация изделия исключает угрозу жизни и материальным ценностям.
Не устанавливайте одновременно новые и использованные батарейки, а также элементы различных типов и от разных производителей
Тип, изготовитель и степень эксплуатации элементов питания, применяемыx совместно в составе единого батарейного блока, должны быть строго одинаковыми. В противном случае, нагрузка в блоке перераспределяется, перегружая слабейший элемент, что быстро приводит к его выходу из строя. Кроме того, качество работы такой батареи будет определяться характеристиками самого худшего источника питания. Для гарантированной работы приобретайте сразу необходимое количество элементов в заводской упаковке от известного бренда.
 Некоторая передышка от процесса выработки энергии позволяет солевым батарейкам восстановить однородность электролита и продлить их «жизнь».
Некоторая передышка от процесса выработки энергии позволяет солевым батарейкам восстановить однородность электролита и продлить их «жизнь». Соблюдайте полярность. Не замыкайте контакты
Не соблюдение данного правила эксплуатации ведёт к нарушению целостности и формы корпуса ЭП, вздутию, утечке электролита и даже взрыву. Повышение внутреннего давления из-за неправильной работы конструкции, которое пытается найти выход в виде взрыва или разрушения стенок закрытого источника питания, может привести к заливанию отсека для батарей химическим реактивом и его порче, к попаданию активных реагентов на внутренние платы и микросхемы и даже к безвозвратному выходу из строя устройства потребителя.
Не стоит давать элементы питания детям
В процессе игры ребёнок может засунуть в рот и проглотить батарейку, что с большой долей вероятности приведёт к проблемам со здоровьем. Попытка же разобрать или повредить корпус источника энергии вызовет вытекание активного электролита, следствием которого может явиться ожог кожных покровов и слизистых оболочек тела. В подобном случае следует незамедлительно промыть пострадавший участок большим количеством воды и обратиться за медицинской помощью.
Попытка же разобрать или повредить корпус источника энергии вызовет вытекание активного электролита, следствием которого может явиться ожог кожных покровов и слизистых оболочек тела. В подобном случае следует незамедлительно промыть пострадавший участок большим количеством воды и обратиться за медицинской помощью.
Возможность перезарядки элементов питания
Содержимое батарейки с течением времени меняется из-за химических реакций. Когда запас исходных элементов истощается, вырастает внутреннее сопротивление, и это означает, что батарейка исчерпала свой ресурс. Она становится непригодной для дальнейшего использования. Заряжать солевые, щелочные, а тем более литиевые батарейки категорически запрещается, так как пользователь подвергает себя и используемое устройство большой опасности, что обусловлено перегревом, и как следствие — высокой вероятностью взрыва, выбросом вредных компонентов и утечкой электролита. Отработанные ЭП требуется обязательно утилизировать в переработку.
Перезарядке подлежат только лишь аккумуляторы! Они имеют специально предназначенную для этого конструкцию. В аккумуляторе реализована возможность под воздействием силы тока повернуть химические реакции вспять, то есть с помощью зарядного устройства восстановить продукты реакции до исходного состояния. Зарядное устройство пропускает через аккумулятор электрический ток, но только в обратном направлении. Структура аккумулятора возвращается в рабочее состояние, и его можно снова задействовать по прямому назначению.
Ni-MH аккумуляторы после приобретения желательно «потренировать». Для этого нужно выполнить 3-4 цикла полной зарядки/разрядки, что позволит достигнуть заявленного предела ёмкости, потерянной при транспортировке и хранении устройства после выхода с конвейера.
Утилизация отработанных элементов питания
Аккумулятор или батарейка, рано или поздно, вырабатывают свой ресурс. Но выбрасывать с бытовым мусором их ни в коем случае нельзя. Под воздействием атмосферных процессов корпус ЭП будет со временем повреждён, и химические реактивы начнут отравлять почву и окружающую среду. Подсчитано, что одна пальчиковая батарейка, выброшенная на свалку, способна провести загрязнение примерно двадцати квадратных метров земли, а в лесу на этой площади живут и растут два дерева, два крота, один еж и несколько тысяч дождевых червей. Поэтому отслужившие свой срок источники питания необходимо сдавать только в специальные пункты приема, откуда они после сортировки пойдут в переработку.
Но выбрасывать с бытовым мусором их ни в коем случае нельзя. Под воздействием атмосферных процессов корпус ЭП будет со временем повреждён, и химические реактивы начнут отравлять почву и окружающую среду. Подсчитано, что одна пальчиковая батарейка, выброшенная на свалку, способна провести загрязнение примерно двадцати квадратных метров земли, а в лесу на этой площади живут и растут два дерева, два крота, один еж и несколько тысяч дождевых червей. Поэтому отслужившие свой срок источники питания необходимо сдавать только в специальные пункты приема, откуда они после сортировки пойдут в переработку.
Рекомендуемые температурные режимы эксплуатации ЭП
При соблюдении указанного диапазона возможна нормальная работа источников питания с максимальным использованием заложенного ресурса по энергоотдаче и сроку службы:
— для щелочных батареек: от -20°С до +50°С ;
— для литиевых ЭП: от -25°С до +60°С ;
— для никель-металлгидридных аккумуляторов: от -20°С до +50°С.

Общие рекомендации по хранению ЭП
Батарейки очень желательно хранить в заводской упаковке. Это обеспечит их защиту от различных факторов окружающей среды и поможет не спутать новые элементы с уже использованными, предохранит контакты от соприкосновения с металлическими поверхностями.
В случае, когда заводская упаковка отсутствует, разместите батарейки в пластиковом или деревянном, но ни в коем случае не металлическом, контейнере.
Не храните вместе с батарейками монеты и другие металлические предметы. Разместите соседние батарейки так, чтобы их положительные и отрицательные полюсы не соприкасались. Если это трудноосуществимо, проложите контактные зоны изолирующим материалом, не проводящим ток.
Храните батарейки при комнатной или чуть более низкой температуре. В большинстве случаев подходит любое прохладное место, в которое не проникают прямые солнечные лучи. Даже при сравнительно высокой температуре 25°C обычная батарейка за год теряет лишь несколько процентов своего заряда.
Хранение батареек при отрицательных температурах не рекомендуется, так как увеличивается саморазряд. Перед использованием взятых из холода батареек лучше будет дать им согреться до комнатной температуры.
Контролируйте влажность воздуха. При повышенной влажности воздуха (более 50%) или опасности образования конденсата батарейки следует держать в герметичном контейнере.
Все на зарядку! – Огонек № 11 (4987) от 12.03.2007
Всеволод БЕЛЬЧЕНКО
Пальчиковые батарейки — один из самых ходовых товаров. Каждый год в мире продается более 30 миллиардов батареек, а оборот отрасли составляет десятки миллиардов долларов. Меняется и структура рынка: если раньше большинство продаж приходилось на дешевые солевые батарейки, то теперь место под солнцем захватывают их более дорогие и долговечные щелочные аналоги. За последние несколько лет их доля на российском рынке выросла с 20 до 63,1 процента. Появляются и новые, более мощные разновидности батареек, например литиевые и Oxyride. «Огонек» выяснил, как правильно подобрать батарейку для любимой техники и при этом не переплатить за дополнительные навороты.
За последние несколько лет их доля на российском рынке выросла с 20 до 63,1 процента. Появляются и новые, более мощные разновидности батареек, например литиевые и Oxyride. «Огонек» выяснил, как правильно подобрать батарейку для любимой техники и при этом не переплатить за дополнительные навороты.
— Батарейку нужно выбирать, исходя из мощности приборов, в которых ее будут использовать, — говорит Максим Дребежков, менеджер компании Battery Team. — Например, в гаджетах с большим потреблением тока, мр3-плеерах и фотокамерах стоит использовать щелочные элементы питания, а для экономичных устройств — пультов дистанционного управления, часов — можно купить дешевые солевые батарейки.
Такое разделение понятно, ведь мощность щелочных батареек в 6 — 8 раз превосходит их солевые аналоги. Однако дело не только в этом.
— Например, элементы питания, работающие в фотокамерах, должны обладать достаточной мощностью и выдерживать большие колебания в энергопотреблении, — уточняет Марина Семенова, менеджер по маркетингу российского представительства компании Varta. — Например, обеспечивать максимальное количество энергии во время съемки и срабатывания вспышки и тут же восстанавливаться для показа снимка на дисплее. Солевые батарейки такими качествами не обладают, так что в лучшем случае их хватит буквально на пару снимков.
— Например, обеспечивать максимальное количество энергии во время съемки и срабатывания вспышки и тут же восстанавливаться для показа снимка на дисплее. Солевые батарейки такими качествами не обладают, так что в лучшем случае их хватит буквально на пару снимков.
Специально для фотокамер некоторые производители выпускают модифицированные щелочные батарейки Oxyride. Они лучше выдерживают пиковые нагрузки и быстрее восстанавливаются, правда, стоят в разы дороже обычных щелочных элементов питания.
Отличить солевые батарейки от щелочных можно по маркировке. Так, на упаковке с солевыми элементами питания будет стоять пометка Normal или Standard, а на блистере с щелочными батарейками — Alkaline. А вот определить качество батареек по их внешнему виду практически невозможно. Не стоит также безраздельно полагаться на известные марки. Ведь почти все батарейки популярных марок, поступающие в Россию, производят в Китае.
Покупатели батареек должны помнить и о правилах безопасности. Старые солевые элементы питания можно было легко «подзарядить» с помощью зажигалки. С щелочными батарейками этого делать не стоит: они могут просто взорваться. То же произойдет и при попытке подключить батарейки к зарядному устройству, предназначенному для подзарядки аккумуляторов. Разряженные солевые батарейки нельзя оставлять внутри приборов: они могут потечь и испортить технику.
Старые солевые элементы питания можно было легко «подзарядить» с помощью зажигалки. С щелочными батарейками этого делать не стоит: они могут просто взорваться. То же произойдет и при попытке подключить батарейки к зарядному устройству, предназначенному для подзарядки аккумуляторов. Разряженные солевые батарейки нельзя оставлять внутри приборов: они могут потечь и испортить технику.
Фото EAST NEWS
Какие батарейки лучше: солевые или алкалиновые?
Конструкция батарей разного типа
Батарейки, в отличие от аккумуляторов, не способны восстанавливать заряд. Протекание реакции в таком химическом элементе происходит в одном направлении. После выработки ресурса гальванические элементы утилизируют.
Самые привычные и распространенные – солевые (R) и алкалиновые (щелочные LR) батарейки похожи только внешне.
На самом деле они имеют ряд серьезных конструктивных отличий, указанных в таблице ниже:
| Параметр | |||
| Тип батарейки | Анод | Катод | Электролит |
| Солевая (R) | диоксид марганца и графита | цинковый корпус | р-р хлорида аммония |
| Алкалиновая (LR) | диоксид марганца | цинковый порошок в стальном корпусе
| гидроокись калия |
Несмотря на внешнюю схожесть, разница в элементах питания отражается не только на эксплуатационных характеристиках, но и стоимости продукта.
Так, производство солевых батареек обходится значительно дешевле, чем выпуск щелочных. Однако LR источники тока обладают в 5-6 раз большей емкостью.
Преимущества и недостатки батареек
Каждый вид гальванических элементов имеет свои сильные и слабые стороны. Чтобы наглядно понять разницу между алкалиновыми и солевыми батарейками, мы собрали их основные параметры в сводную таблицу:
| Характери- стика | Емкость, мА*час | Срок хране- ния, лет | Работо- способность при темпе- ратурах | Герме- тичный корпус | Вес | Себесто-имость |
| Алкалиновая | 1000-2980 | 10 | + | + | – | – |
| Солевая | 550-1500 | 2 | – | – | + | + |
Из предоставленной информации можно сделать вывод, что солевые батарейки легкие и стоят дешевле.
При этом ресурс элементов адаптирован для питания оборудования с низким энергопотреблением. Сюда можно отнести всевозможные пульты управления и кварцевые часы, фонари, игрушки, мультиметры и другое диагностическое оборудование.
Есть недостатки в виде небольшой емкости и ограниченного срока службы. К тому же солевые батарейки могут потечь – их лучше не оставлять в неиспользуемых приборах.
В то же время алкалиновые источники тока долговечны, имеют в пять раз больший ресурс и высокий уровень эксплуатационной безопасности.
Недостатки щелочных элементов – они тяжелее и стоят дороже.
И солевые, и алкалиновые батарейки представлены в цилиндрическом корпусе с напряжением 1,5
В типоразмеров ААА, АА, C, D и элементы на 9 В типа «Крона».
Торговая марка GoPower предлагает солевые и алкалиновые батарейки всех наиболее распространенных типоразмеров.
Солевые батарейки GoPower отличаются максимальной защитой от протечек благодаря использованию премиальных компонентов и полностью автоматизированному производству.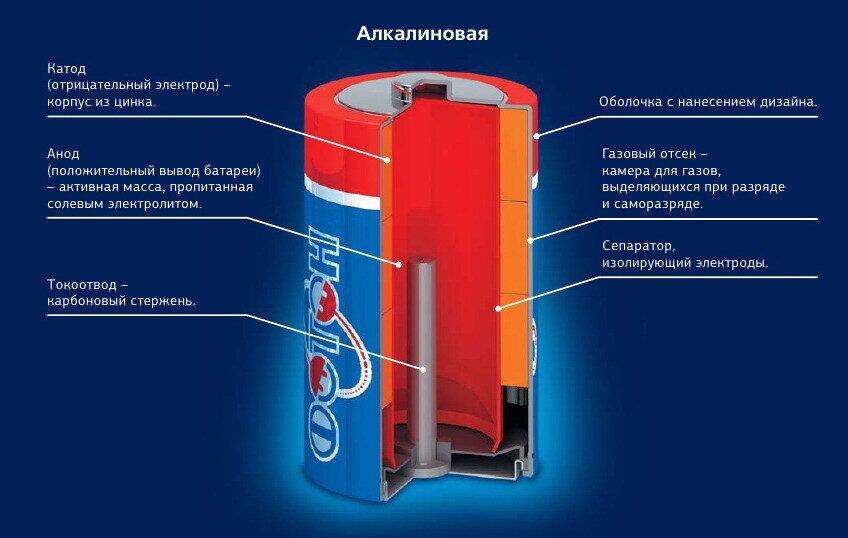
Алкалиновые батарейки GoPower зарекомендовали себя как лучший выбор по соотношению цена – качество на российском рынке, т.е. по тому количеству энергии и времени работы, который получает потребитель за 1 рубль, существенно превосходя по этому параметру многие известные международные торговые марки.
разбираем достоинства и недостатки разных видов
25.11.2019Какие батарейки лучше купить: разбираем достоинства и недостатки разных видов
Какие батарейки лучше купить: разбираем достоинства и недостатки разных видовНесмотря на растущую популярность аккумуляторов, по-прежнему остается стабильным спрос на классические батарейки — пальчиковые, мизинчиковые и другие. Это объясняется не только ценовой доступностью такого энергоисточника, но и его удобством. Чтобы дать достаточный уровень подпитки для того или иного оборудования, достаточно заглянуть в любой магазин или даже уличный ларек — там почти всегда можно купить батарейки АА или ААА.

Но что делать, если рынок буквально завален предложениями, и вы никак не можете определиться, какие батарейки выбрать? Данная статья даст полный ответ на этот вопрос.
Батарейки — какие предпочесть? Разбираемся в преимуществах и минусах разных типов
1. Хорошо разрекламированные и популярные литиевые батарейки имеют массу плюсов:
+ Обладают высокой емкостью и энергоэффективностью.
+ Им не страшен высокий рабочий ток.
+ Долго служат, а также отличаются очень длительным сроком хранения при минимальных потерях уровня заряда.
+ Имеют небольшой вес.
+ Достаточно хорошо переносят экстремальные условия: способны стабильно функционировать при высоких и низких температурах.
А среди их недостатков, пожалуй, можно выделить лишь довольно высокую стоимость. Однако если речь идет о поиске надежного и высокоемкостного энергоэлемента с легким весом и способного стабильно работать в морозы и жару, несомненно, стоит обратить внимание на литиевые батарейки.
2. Солевые батарейки — это один из самых распространенных вариантов, основным преимуществом которого можно выделить очень доступную цену и наличие на полках большинства магазинов.
Однако этот тип батареек имеет сразу несколько существенных минусов, среди которых:
– Недолгий срок хранения из-за быстрого саморазряда.
– Неспособность стабильно работать при низких температурах (падает емкость заряда).
– В процессе разряда наблюдается сильное падение уровня напряжения.
Но если ориентироваться только на дешевую цену, то именно солевые батарейки признаны одними из самых легкодоступных — под любой бюджет.
3. Щелочные батарейки, которые также прозвали, как алкалиновые батарейки (от англ. Alkaline — «щелочь»), выделяются хорошим списком достоинств:
+ Повышенный уровень емкости.
+ Долгий срок хранения (в среднем до 5 лет) при низком показателе саморазряда.
+ Очень хорошая герметичность корпуса.
+ Способность работать даже при довольно низких температурных режимах.
Но и минусы у такого типа батареек тоже присутствуют, это:
– Довольно большой вес.
– Высокая цена, которая не намного меньше, чем у функциональных литиевых батареек.
– Во время разряда часто наблюдается снижение уровня напряжения.
Теперь, когда вы знаете все основные достоинства и недостатки разных типов, купить батарейки с оптимальными для вас параметрами не составит труда.
Тест 16 «пальчиковых» батареек АА: Обзоры: Компьютеры — Ferra.ru
Ртутные элементы питания. В них используют оксид ртути, катод выполнен из смеси порошка цинка и ртути, анод и катод разделены сепаратором и диафрагмой, пропитанной 40% раствором щёлочи. Они также имеют длительные сроки хранения, при этом отличаются более высокой ёмкостью при таком же объёме и габаритах.
Серебряные элементы питания имеют катоды из оксида серебра, и напряжение их на 0,2 В выше, чем у угольно-цинковых в одних и тех же условиях. В остальном эти элементы питания похожи на угольно-цинковые.
В остальном эти элементы питания похожи на угольно-цинковые.
Литиевые элементы питания обладают очень большим сроком хранения, высокой плотностью энергии и сохраняют работоспособность в большом диапазоне температур, поскольку не содержат воды. В их состав входит литиевый катод, органический электролит и анод из различных материалов, так как литий имеет отрицательный наивысший потенциал по отношению к остальным металлам — следовательно, имеет наибольшее номинальное напряжение при минимальных размерах.
Основными источниками питания, которыми пользуются потребители, являются марганцево-цинковые (солевые) и щелочные (alkaline). Вот их-то мы рассмотрим, но сначала расшифруем буквенные и цифровые значения на батарейках. Например на батарейке есть такая надпись: R6 AA 1.5V.
R в данном означает марганцево-цинковый цилиндрический элемент, 6 — порядковый номер в международной классификации, 1.5V — номинальное напряжение новой батареи, AA — типоразмер по американскому стандарту, также может стоять буква P, означающая «улучшенные». Если в обозначении батарейки стоит буква L — например LR6 AA 1.5V, — значит, это батарея щелочная, то есть «alkaline». На корпусах элементов питания производители могут писать «0% MERCURY & 0% CADMIUM», что, соответственно, обозначает: кадмия и ртути в составе элемента питания нет.
Если в обозначении батарейки стоит буква L — например LR6 AA 1.5V, — значит, это батарея щелочная, то есть «alkaline». На корпусах элементов питания производители могут писать «0% MERCURY & 0% CADMIUM», что, соответственно, обозначает: кадмия и ртути в составе элемента питания нет.
Ниже приведен список «подопытных» элементов питания, которые удалось найти в свободной розничной продаже. Каждый элемент питания был куплен в нескольких экземплярах с целью проведения теста при разных интенсивностях нагрузок, поскольку у каждого потребителя энергии разное потребление тока, а соответственно, поведение батареек должно быть разное.
В табличке перечислены все купленные нами экземпляры, а также указана их средняя розничная цена за штуку.
Факты и вымыслы про батарейки
Ваши вопросы
Вымысел или факт? Батарейки должны храниться в холоде.
Вымысел. Охлаждение батареек не улучшает их работоспособность. Батарейки необходимо хранить в сухом месте при комнатной температуре.
Вымысел или факт? Все типоразмеры батареек работают одинаково долго.
Вымысел. Различные типоразмеры батареек содержат различное количество химических веществ, в результате реакции которых выделяется определенное количество электрической энергии. Соответственно, батарейки работают не одинаково.
После использования батарейку можно выбросить в обычное мусорное ведро. Факт или Вымысел?
Большинство батареек можно утилизировать обычным способом. Важно не утилизировать большое количество батареек одновременно. Зачастую утилизируемые батарейки не полностью разряжены. Взаимодействие неразряженных батареек с разряженными может создавать определённые риски для окружающей среды.
Что находится внутри батарейки?
Батарейки зачастую малы, но довольно сложно устроены. Это высокотехнологичные элементы, в которых в результате химических реакций выделяется электрическая энергия. Данный процесс происходит между тремя главными элементами батарейки: анодом, катодом и электролитом. В зависимости от типа батарейки для перечисленных элементов используются различные материалы. Материал выбирается по принципу максимизации эффекта при их взаимодействии. Анод часто делают из металла, катод — из оксида различных металлов. В качестве электролита используется соль, в щелочных батарейках — двуокись марганца.
В зависимости от типа батарейки для перечисленных элементов используются различные материалы. Материал выбирается по принципу максимизации эффекта при их взаимодействии. Анод часто делают из металла, катод — из оксида различных металлов. В качестве электролита используется соль, в щелочных батарейках — двуокись марганца.
Батарейки имеют различное напряжение и ёмкость?
Различные устройства работают с различным напряжением, поэтому и у батареек оно должно быть разным. Кроме того, напряжения разных типов батареек зависит от используемого электролита. К примеру, литиевые батарейки имеют номинальное напряжение 3 V, щелочные — 1,5 V.
Ёмкость батареек рассчитывается из объёма активных элементов, помещаемых в корпус батарейки. Однако расчитанная подобным образом ёмкость не может быть использована для определения работоспособности батареек и имеет название «расчетная ёмкость». Фактическая же ёмкость зависит от множества факторов:
• уровень зарядки;
• режим использования;
• температура окружающей среды;
• ток отсечки (Напряжение, при котором устройство не работает даже при сохранённом заряде батарейки. Например, батарейка, которая уже не работает в фотоаппарате, зачастую продолжает работать в часах или пультах управления).
Например, батарейка, которая уже не работает в фотоаппарате, зачастую продолжает работать в часах или пультах управления).
Что такое щелочная батарейка?
Около 40 лет назад компания Duracell первой разработала щелочную химическую систему с использованием двуокиси марганца. В 1960-1970-ые годы данные батарейки стали очень популярны среди разработчиков электронных устройств. Щелочные батарейки имеют множество преимуществ перед солевыми: большая емкость, более широкий температурный режим, меньшая вероятность протечки, дольший срок хранения. Все это позволило им завоевать популярность во всем мире.
Что такое литиевая батарейка?
В
последние несколько деситилетий технический прогресс привёл к увеличению разнообразия и миниатюризации устройств, работающих от батареек. Для многих из этих устройств потребовались более мощные элементы питания, при этом достаточно компактные. Литиевые батарейки стали ответом на такую потребность. Литиевые батарейки Duracell демонстрируют великолепные результаты и обладают целым рядом положительных характеристик: долгий срок хранения, высокая надёжность и отличная работоспособность в широком диапазоне температур.
Литиевые батарейки Duracell демонстрируют великолепные результаты и обладают целым рядом положительных характеристик: долгий срок хранения, высокая надёжность и отличная работоспособность в широком диапазоне температур.
Вымысел или факт? Чтобы продлить срок функционирования батареек в устройстве, нужно заменять лишь некоторые из них.
Вымысел. На самом деле все наоборот: частичная замена батареек ведет к уменьшению их работоспособности. Совместное использование частично разряженных и новых батареек ведет к уменьшению их совокупной емкости. Duracell рекомендует использовать в устройствах батарейки не только одного типа, но и одного производителя.
Вымысел или факт? Необходимо избегать контактов с протекшими батарейками без какой-либо защиты, чтобы избежать попадания электролита в глаза.
Факт. Батарейки содержат химические элементы, которые не приносят вреда коже, однако лучше избегать подобных контактов. Всегда принимайте меры предосторожности, прежде чем прикасаться к протекшей батарейке. Не держите протекшую батарейку около глаз и не допускайте попадания электролита в глаза. Если же это произойдет, срочно обратитесь к врачу.
Не держите протекшую батарейку около глаз и не допускайте попадания электролита в глаза. Если же это произойдет, срочно обратитесь к врачу.
Вымысел или факт? Если батарейки поместить в огонь, они могут взорваться.
Факт. Батарейки нельзя помещать в огонь или подвергать высокотемпературному воздействию. Они могут взорваться и причинить вред здоровью и окружающей среде.
Вымысел или факт? В одном устройстве можно использовать различные типы батареек без каких-либо проблем.
Вымысел. Изначально различные батарейки созданы для различных устройств. Совместное использование литиевых и щелочных батареек не улучшит , а только ухудшит их работу. Более того, подобное использование батареек может испортить устройство. Duracell рекомендует использовать в устройствах батарейки не только одного типа, но и одного производителя.
Можно ли перезаряжать батарейки?
Перезаряжать можно те батарейки, на которых указано «аккумуляторы» или «rechargeable» (пер. с англ. — перезаряжаемый). Любые попытки перезарядки остальных батареек приведут к их протечке.
с англ. — перезаряжаемый). Любые попытки перезарядки остальных батареек приведут к их протечке.
Нормально ли то, что NiMH аккумуляторы нагревыаются в процессе зарядки?
Да, это нормально. В процессе зарядки NiMH аккумуляторы могут нагреваться до температуры 45°С.
Влияет ли теплая / холодная температура на работу батареек?
Экстремальные температуры уменьшают работоспособность батареек. Нежелательно использовать батарейки при высоком уровне влажности. Хранить же батарейки стоит в сухом месте при комнатной температуре.
Почему в одних устройствах батарейки расположены параллельно, а в других — последовательно.
Работа батареек зависит от способа их подключения. При последовательном подключении, как например, в фонарике, увеличивается напряжение в цепи. При последовательном соединении 2-х батареек с напряжением 1,5 V — напряжение в цепи становится 3 V. Последовательное подключение не увеличивает срок службы батареек, но позволяет цепи работать с большим напряжением. Параллельное соединение используется для повышения силы тока в цепи и, соответственно, для увеличения емкости батарейки. Таким образом, параллельное подключение 2-х батареек сохранит напряжение в сети на уровне 1,5 V, но вдвое увеличит их емкость.
Параллельное соединение используется для повышения силы тока в цепи и, соответственно, для увеличения емкости батарейки. Таким образом, параллельное подключение 2-х батареек сохранит напряжение в сети на уровне 1,5 V, но вдвое увеличит их емкость.
Причиняют ли батарейки вред окружающей среде?
В данный момент подавляющее количество батареек, в особенности стандартные батарейки типоразмеров АА, ААА, С, D, 9V, не содержат в себе ртути и кадмия. С другой стороны, тяжёлые металлы всё ещё входят в состав ртутных батарей, NiCd и целого ряда автомобильных аккумуляторов. Эти металлы могут причинять вред окружающей среде при их ненадлежащей утилизации. Duracell не использует в своих батарейках тяжёлые металлы. Индустрия батареек активно работает над тем, чтобы полностью отказаться от использования тяжелых мателлов (ртуть, кадмий, свинец).
Закажите аккумуляторы и батарейки в нашем магазине.
Просмотров: 17375
Дата: Четверг, 07 Июля 2011
Содержание: Марки в тесте:

ТЕСТИРОВАНИЕ Соль щелочи — близкий родственник. Большинство потребителей, покупая батарейки, даже не задумываются над самим фактом типа батарейки — главное чтобы размер был подходящий. Частично это оправдано и не имеет реально большого значения. Но не всегда. Чем сложнее и энергоемче устройство, тем больше энергии ему требуется и соответственно тем дольше оно проработает. Самыми распространенными видами батареек являются щелочные и солевые. Конструктивно они одинаковы и отличаются видом электролита. Более простыми являются солевые батарейки. Кстати производители щелочных батареек любят себя сравнивать именно с ними, называя их «обычными». Именно эти самые доступные батарейки и прошли тернистый путь сравнительного тестирования. В исследование мы взяли самый популярный размер, так называемый «пальчиковый», а если быть более точными то формат АА (он же R6).
Маркировка и Упаковка Упаковка и Маркировка.  Значительная часть батареек может продаваться поштучно и чаще всего они комплектуются по 4 штуки в обычном целлофане с очень маленькой этикеткой. Гораздо более приемлемой упаковкой и соответственно маркировкой является картонная этикетка с приклеенным пластиком с батарейками внутри. Но с точки зрения защиты содержимого (в первую очередь от замыкания контактов) замечаний к упаковки не было, и мы посчитали возможным не оценивать упаковки, а сосредоточится на маркировке. Значительная часть батареек может продаваться поштучно и чаще всего они комплектуются по 4 штуки в обычном целлофане с очень маленькой этикеткой. Гораздо более приемлемой упаковкой и соответственно маркировкой является картонная этикетка с приклеенным пластиком с батарейками внутри. Но с точки зрения защиты содержимого (в первую очередь от замыкания контактов) замечаний к упаковки не было, и мы посчитали возможным не оценивать упаковки, а сосредоточится на маркировке.И вот здесь возвращаемся к маленькой этикетке. Настолько маленькой, что даже весьма нужные данные, и не просто нужные, но и обязательные, на ней отсутствуют. За это мы, конечно же, существенно снизили оценки. К таким образцам относятся батарейки GP и Philips с оценками «очень плохо» и «плохо». У них вообще отсутствовала информация о производителе и поставщике. До «удовлетворительно» были снижены оценки за маркировку у батареек Maxell, Panasonic и Sony. Технические испытания
Время разряда. Здесь все понятно, чем больше время разряда, тем больше проработает батарейка и электроприбор. Естественно, что самым малым временем работы отличаются высокие нагрузки. Время работы колеблется от 5 ч. 55 мин («Наша сила») и 5 ч. 25 мин (Philips) до 3 ч. При средних нагрузках время работы составило от 13 ч. 20 мин («Наша сила») и 12 ч. 20 мин (Panasonic) до 8 ч. 00 мин («Эксперт»). При малых нагрузках время работы тестируемых батареек составило от 87 ч. 36 мин (Sony) и 85 ч. 12 мин (Varta) до 62 ч. 24 мин («Эксперт»). Отданная энергия. Полученная прибором и соответственно отданная батарей энергия выражается в Джоулях (Дж). В этом пункте зависимость такая же, как и у времени разряда: чем больше энергии отдаст батарея, тем лучше для пользователя (все полученные данные отражены в таблице ниже). Цена 1 кДж (килоджоуля). Собственно говоря, как было сказано выше, энергия измеряется в Джоулях и задача батарейки выдать нужную нам энергию с минимальными затратами. Т.е. чем меньше денег, тем лучше для нашего кармана. Высчитывается она просто, исходя из цены одной батарейки и отданной энергии. Поскольку отданная энергия отличается в зависимости от нагрузки, и то и цена будет отличаться. При высокой нагрузке самыми выгодными образцами получились батарейки «Наша сила» (1,02 грн.), Maxell (1,19 грн.) и Philips (1,59 грн.). При средней нагрузке самыми выгодными батарейками получились Maxell (0,82 грн.), «Наша сила» (0,84 грн.) и Panasonic (1,20 грн.). При низкой нагрузке самыми выгодными батарейками получились Maxell (0,48 грн.), «Наша сила» (0,60 грн.) и Panasonic (0,73 грн.). Внутреннее сопротивление. Этот пункт измерений показывает, насколько долго продержится батарейка без работы (т.е. имеет меньше потери энергии), соответственно имеет низкий саморазряд. Измеряется в Ом и чем меньше полученная цифра, тем лучше.
Первоначальное напряжение. Данные, полученные в начале работы батарей, т.е. каково реальное напряжение было в батарейках. Все образцы заявлены с напряжением 1,5 В, по факту несколько больше у всех. Так что замечаний здесь не было.
данные тестирования носят рекомендательный и информационный характер для потребителей и не являются обязательными к исполнению.  Окончательное
решение за потребителем. Окончательное
решение за потребителем. Общие описания принципов тестирований здесь… ICRT — ENERG (№488) Вложения:
| |||||
Типы батарей и отличия: солевые, щелочные и перезаряжаемые
Все мы точно знаем, что такое батарея, однако существуют разные типы батарей: щелочные или солевые, обычные или перезаряжаемые. Вы можете просто пойти и купить самый экономичный вариант без чего-либо, кроме типа батареи, которая есть у машины, которая их хочет. Хотя это может зависеть от многих элементов, которые нам нужны, мы будем различать разные типы батарей: щелочные, солевые и перезаряжаемые батареи.В перезаряжаемых батареях мы также можем обнаружить различные типы батарей в соответствии с их составом.
Разновидности батарей
В первую очередь мы занимаемся поиском одноразовых батарей и перезаряжаемых батарей. Но каждый из них, в свою очередь, делится на ряд подтипов. Это определяется сочетанием одного и противоположного, мы обнаружим ряд преимуществ, эквивалентных большей или меньшей полезной жизни, большей или меньшей энергии или основному воздействию воспоминаний, которое не позволяет нам перезаряжать одну вещь до ее окончания. батарея полностью разряжена.Мы оцениваем их варианты.
Это определяется сочетанием одного и противоположного, мы обнаружим ряд преимуществ, эквивалентных большей или меньшей полезной жизни, большей или меньшей энергии или основному воздействию воспоминаний, которое не позволяет нам перезаряжать одну вещь до ее окончания. батарея полностью разряжена.Мы оцениваем их варианты.
Одноразовые батарейки
В этих первых мы обнаруживаем дифференциацию: щелочные батареи или солевые батареи. Различие между одним и противоположным заключается в их составе.
Соленые батарейки
Соленые батареи — это те, которые мы обычно находим по самой низкой цене, , по сути, самая доступная по цене батарея , которая может быть в любом магазине. Внутри солевые батареи работают с хлоридом цинка и хлоридом аммония в качестве электролита.По сути, они являются наиболее экономичными, а те, которые используются реже всего, почти не используются, поскольку щелочные батареи почти всегда являются теми, которые решает купить каждый покупатель. Тем не менее, вполне возможно, что вы обнаружите этот тип батареи, если собираетесь ее купить и ищете по самой доступной цене. Они могут быть хорошей возможностью, если вы ищете батареи для инструмента, который не требует чрезмерного количества энергии или который вы не используете часто.В этом случае они часто ценят это.
Тем не менее, вполне возможно, что вы обнаружите этот тип батареи, если собираетесь ее купить и ищете по самой доступной цене. Они могут быть хорошей возможностью, если вы ищете батареи для инструмента, который не требует чрезмерного количества энергии или который вы не используете часто.В этом случае они часто ценят это.
Щелочные батареи
Различие с солевыми батареями, как мы определили в предыдущих параграфах, заключается в их составе. Щелочные батареи имеют больший срок службы, они прослужат дольше и имеют следующую плотность мощности или что-то подобное, дополнительную энергию, если машина требует этого. Они различаются по своему составу: гидроксид калия используется здесь как электролит в себестоимости производства электроэнергии, как заменитель хлорида, использовавшегося более ранними.Они подходят, прежде всего, если вы собираетесь приобрести устройства, которые потребляют много энергии, или если вам нужно, чтобы батарея работала дольше.
Преимущества и недостатки
Это те, которые мы видели всю жизнь дома. Наиболее типичными являются AA , которые могут быть в цифровых игрушках, в элементах управления, в электрической зубной щетке… Основное преимущество заключается в том, что они недороги, и мы найдем их где угодно. Когда они завершены, мы заменяем их другими.Еще одним преимуществом является то, что они часто имеют увеличенное время до их использования.
Его главный недостаток в том, что эти батареи садятся, и мы должны всегда иметь запасной. Если у нас не будет или мы не сможем купить продукты, мы будем обслуживать эту неиспользуемую машину, пока не уйдем домой. Еще одним недостатком, связанным с тем, что они являются обычными или одноразовыми, является их загрязнение: эти батареи чрезвычайно загрязняют окружающую среду, и использование перезаряжаемых батарей по сравнению с обычными сэкономило бы нам большое количество батарей, которые идут в отходы и обычно не всегда перерабатываются.
Аккумуляторы
Аккумуляторы, как следует из названия, можно заряжать без необходимости выбрасывать их, как только они разрядятся. Многие из них будут перезаряжаться более тысячи раз , так что вы всегда будете избегать загрязнения необходимостью вытаскивать щелочные или солевые батареи и покупать новые. Существует несколько разновидностей аккумуляторных батарей, которые различаются по своему составу, но это является определяющим, поскольку существуют дополнительные различия в преимуществах или недостатках, которые мы будем обнаруживать в повседневной жизни.
Мы часто обнаруживаем никель-кадмиевые (NICD) , никель-сталь-гидридные (NiMH) батареи и ионно-литиевые (Li-Ion) батареи. Первые часто встречаются реже всего и не используются годами или, по крайней мере, мы будем видеть их гораздо реже при покупке новых. У них более короткий срок службы, чем у других, и у них есть хороший недостаток, связанный с эффектом памяти, который мы обнаружили в первых сотовых телефонах: на способность зарядки влияет, если мы платим за него до того, как он полностью разрядится. Мы должны позаботиться о его полном получении.
Мы должны позаботиться о его полном получении.
В свою очередь, мы находим NiMH аккумуляторы , которые являются наиболее распространенными и, по сути, наиболее целесообразными. Без влияния на память мы будем загружать их в любое время, когда захотим, и у них больше возможностей. Эти типы батарей являются наиболее распространенными, и их вы обычно обнаружите, если пойдете покупать их в магазине.
Третий, и гораздо реже, это литий-ионный . Они заметно дороже, но хорошего качества из-за их высокой мощности и повышенной устойчивости к разряду.C , потому что предыдущий, они не имеют эффекта памяти, они очень удобны, но, как мы говорим, дороже. Кроме того, это может зависеть от машины, где вы собираетесь их использовать, потому что они очень чувствительны к чрезмерным температурам. У них даже есть недостаток, заключающийся в более быстрой деградации.
Преимущества и недостатки
Очевидно, что преимущество аккумуляторных батарей в том, что их можно перезаряжать, поэтому нам не придется беспокоиться о том, что у есть запасные батареи дома. Если тот, который мы используем в качестве будильника в воскресенье вечером, израсходован, просто оцените его и снова поместите в машину. С другой стороны, они дороже, чем щелочные, и также требуют дополнительных затрат, потому что нам нужна их зарядка.
Если тот, который мы используем в качестве будильника в воскресенье вечером, израсходован, просто оцените его и снова поместите в машину. С другой стороны, они дороже, чем щелочные, и также требуют дополнительных затрат, потому что нам нужна их зарядка.
Другим принципиальным недостатком является то, что обычно использование аккумуляторных батарей, в терминах периода , намного меньше. То есть, если вы собираетесь использовать инструмент в течение очень долгого времени (аналогично дистанционному управлению телевизором), настоятельно рекомендуется использовать обычные батареи, так как цикл их разрядки намного медленнее, чем в корпус аккумуляторных батарей.
Купить батарейки
Это будет зависеть от того, как вы будете использовать его, чтобы купить тот или иной. Если вы просто решили купить одноразовые батареи, лучше использовать щелочные батареи, потому что они более эффективны, чем солевые батареи, которые не используются, хотя и дешевле.
Одноразовый или перезаряжаемый? Принимая во внимание преимущества и недостатки, описанные в предыдущих абзацах, перезаряжаемые батареи часто более желательны, если вы собираетесь приобрести довольно распространенный тип, который удобно всегда иметь под рукой, как в случае AA и AAA. , например, которые мы всегда имеем в органах управления или в любой цифровой машине.Если это гораздо менее частый и конкретный манекен, это не будет выгодной ставкой на подзарядку или вложение дополнительных средств в зарядное устройство и так далее.
Конечно, и некоторые, и другие должны быть правильно переработаны в специальных контейнерах, которые в Испании часто присутствуют на автобусных остановках или в специализированных магазинах. Обычные батареи очень загрязняют окружающую среду, и это недостаток не только в долгосрочной перспективе, но и в краткосрочном периоде, поэтому очень важно помнить о месте их установки.
Что искать?
Если вы собираетесь покупать аккумуляторы, мы предоставим вам некоторые элементы, которые вы обнаружите. Обычно мы смотрим только на стоимость и на то, соответствует ли модель тому, что нужно оборудованию или игрушке, но это не единственный важный или решающий фактор.
Обычно мы смотрим только на стоимость и на то, соответствует ли модель тому, что нужно оборудованию или игрушке, но это не единственный важный или решающий фактор.
- Размер штабеля . Очевидно, что вы должны принять это к сведению. Это не будет идентично для тех, кто использует батарею AA, наиболее типичную, чем AAA чуть меньшего размера.Или C, значительно толще и короче, чем предыдущие. В этом случае взгляните на его измерение.
- Грузоподъемность . Если вы собираетесь приобрести перезаряжаемые батареи, мы должны обратить внимание на нагрузочную способность, которую они означают. Чем больше емкость, тем больше времени обычно требуется для зарядки аккумулятора. Этот цикл будет длиться дольше. Обычно вы увидите возможность зарядки, обозначенную «мАч».
- Состав : Как мы определили в предыдущих параграфах, если вы собираетесь приобрести перезаряжаемые батареи, не все из них идентичны, и состав может различаться.
 Основываясь на показаниях и вариантах, выберите тот, который вы считаете наиболее удобным.
Основываясь на показаниях и вариантах, выберите тот, который вы считаете наиболее удобным. - Количество циклов перезарядки : Обычно это может быть указано в описании продукта или, по крайней мере, расчетное количество. Аккумуляторы NiMH часто выдерживают от 1000 до 1500 циклов затрат, поэтому они рассчитаны на два или три года.
- Предварительно заряженные аккумуляторы : Если вы собираетесь в поездку и покупаете аккумуляторы, например, для своей цифровой камеры, полезно проверить, не заряжены ли они уже.Аккумуляторы часто должны находиться в гнезде перед началом использования, поэтому эта функция будет полезна.
Зарядные устройства
Если вы решили приобрести перезаряжаемые батареи, вы также должны приобрести подходящее зарядное устройство. Безопасной ставкой является их коллективная покупка. То есть купите аккумуляторы с зарядным устройством в идентичном комплекте и будете знать, что они абсолютно подходят. Но можно даже приобрести зарядные устройства. При покупке зарядных устройств мы всегда должны помнить о последовательности элементов:
Но можно даже приобрести зарядные устройства. При покупке зарядных устройств мы всегда должны помнить о последовательности элементов:
- Состав пил а: Как мы уже упоминали, состав аккумуляторов разный. Убедитесь, что зарядное устройство подходит. Как правило, наиболее распространенными являются зарядные устройства NiMH, которые вы увидите по многим ценам.
- Количество загрузочных отверстий . Сколько батарей вы можете загрузить в слоты без задержки. Мы найдем их в двух, но лучше иметь не менее 4 совершенно разных слотов для аккумуляторов, хотя есть еще восемь, двенадцать или восемнадцать слотов на ваше усмотрение.
- Совместимые размеры : Большинство из них подходят для батареек АА и ААА, однако будьте осторожны при выборе того или иного манекена.
- Скорость : Очень важно понять, как долго мы должны ждать. Они часто намного дороже, если они быстрее, но гораздо более целесообразны, если мы все время спешим и должны быть готовы к этому.

- Индикатор заряда. Узнать о завершении метода намного проще, если приобретаемая вами машина оснащена дисплеем с индикатором стоимости.Большинство из этих моделей включают в себя небольшой экран, где мы можем видеть движение батареи в каждом из отверстий, как если бы это была батарея.
Эффективность физической обработки солевых и щелочных отработанных батарей | Интернет-исследования в области здравоохранения и окружающей среды (HERO)
ID ГЕРОЯ
8164733
Тип ссылки
Встречи и симпозиумы
Заголовок
Эффективность физической обработки физиологического раствора по сравнению сщелочные отработанные батарейки
Авторы)
Кабрал, М; Ногейра, Калифорния; Маргаридо, Ф.
Год
2008 г.
Место расположения
Канкун
Заголовок книги
2008 Глобальный симпозиум по переработке, переработке отходов и чистым технологиям, REWAS 2008
Номера страниц
1045-1050
Язык
английский
Абстрактный
Физическая обработка отработанных батарей, включающая измельчение и просеивание, является первым этапом химической обработки с помощью гидрометаллургии. Лабораторное исследование было проведено для оценки эффективности физической обработки путем анализа полученного размера частиц щелочных и солевых миньонных батарей Zn-MnO2. После измельчения с помощью измельчителя наконечников полученные результаты показали, что щелочные батареи уменьшались в размерах более эффективно, чем батареи с солевым раствором. Разница в гранулометрическом составе была больше для гранулометрической фракции -20+11,2 мм, а также выше для солевых батарей. Средние диаметры (d50) для солевых и щелочных батарей были соответственно 9.1 и 6,2 мм. Химический состав, проведенный на нескольких гранулометрических фракциях, позволил выявить распределение металлов по классам крупности. Этот анализ показал, что концентрация цинка с размером зерна была почти постоянной, в то время как содержание марганца уменьшалось с увеличением размера частиц. Более 95 % железного лома из корпусов батарей имели размер частиц более 5,6 мм.
Лабораторное исследование было проведено для оценки эффективности физической обработки путем анализа полученного размера частиц щелочных и солевых миньонных батарей Zn-MnO2. После измельчения с помощью измельчителя наконечников полученные результаты показали, что щелочные батареи уменьшались в размерах более эффективно, чем батареи с солевым раствором. Разница в гранулометрическом составе была больше для гранулометрической фракции -20+11,2 мм, а также выше для солевых батарей. Средние диаметры (d50) для солевых и щелочных батарей были соответственно 9.1 и 6,2 мм. Химический состав, проведенный на нескольких гранулометрических фракциях, позволил выявить распределение металлов по классам крупности. Этот анализ показал, что концентрация цинка с размером зерна была почти постоянной, в то время как содержание марганца уменьшалось с увеличением размера частиц. Более 95 % железного лома из корпусов батарей имели размер частиц более 5,6 мм.
Ключевые слова
Физическая обработка; Переработка; Отработанные батареи
границ | Недавний прогресс в электролитах «вода-в-соли» в отношении перезаряжаемых батарей без лития
Введение
В последнее время вопросы безопасности и стоимость производства перезаряжаемых батарей становятся основными факторами, ограничивающими их коммерческое применение в портативных электронных устройствах (PED), электромобилях (EV) и стационарных электронных системах накопления энергии (EES) (Wang et al. , 2007; Суо и др., 2015; Лукацкая и др., 2018). Таким образом, как эффективно выбрать подходящие материалы, используемые в батареях, стало важной и сложной темой. Как важный компонент батарей, электролиты играют жизненно важную роль в превосходных электрохимических характеристиках батарей, и в последние годы они привлекают все больше и больше внимания (Kandhasamy et al., 2012; Yan et al., 2012; Suo et al. , 2013). Хотя традиционные органические электролиты нашли применение в перезаряжаемых батареях, они по своей природе содержат большое количество дорогих, но легковоспламеняющихся органических растворителей с определенным уровнем токсичности, что делает условия сборки устройства относительно жесткими (Wang et al., 2012; Сюй и Ван, 2016 г.; Ян и др., 2019а). Следовательно, водные электролиты были признаны многообещающими альтернативными кандидатами для усовершенствованных перезаряжаемых батарей с момента их первого применения в литий-ионных батареях (LIB) (Li et al., 1994). Водные батареи обладают явными достоинствами, включая низкую стоимость, высокую безопасность, высокую электронную проводимость, мягкую среду сборки и т.
, 2007; Суо и др., 2015; Лукацкая и др., 2018). Таким образом, как эффективно выбрать подходящие материалы, используемые в батареях, стало важной и сложной темой. Как важный компонент батарей, электролиты играют жизненно важную роль в превосходных электрохимических характеристиках батарей, и в последние годы они привлекают все больше и больше внимания (Kandhasamy et al., 2012; Yan et al., 2012; Suo et al. , 2013). Хотя традиционные органические электролиты нашли применение в перезаряжаемых батареях, они по своей природе содержат большое количество дорогих, но легковоспламеняющихся органических растворителей с определенным уровнем токсичности, что делает условия сборки устройства относительно жесткими (Wang et al., 2012; Сюй и Ван, 2016 г.; Ян и др., 2019а). Следовательно, водные электролиты были признаны многообещающими альтернативными кандидатами для усовершенствованных перезаряжаемых батарей с момента их первого применения в литий-ионных батареях (LIB) (Li et al., 1994). Водные батареи обладают явными достоинствами, включая низкую стоимость, высокую безопасность, высокую электронную проводимость, мягкую среду сборки и т. д. (Wang et al., 2007; Baskar et al., 2014; Huang et al., 2019a). Однако окно напряжения электрохимической стабильности аккумуляторов на водной основе составляет всего ~1.23 В, что серьезно ограничивает оптимальный выбор материалов катода и анода из-за существования реакций выделения водорода и/или кислорода. Это исключает большинство электрохимических пар, возникающих выше выходного напряжения 1,5 В, что ограничивает повышение плотности энергии полных устройств (Lu et al., 2011; Kim et al., 2014; Jiang et al., 2019a; Liu et al. ., 2020).
д. (Wang et al., 2007; Baskar et al., 2014; Huang et al., 2019a). Однако окно напряжения электрохимической стабильности аккумуляторов на водной основе составляет всего ~1.23 В, что серьезно ограничивает оптимальный выбор материалов катода и анода из-за существования реакций выделения водорода и/или кислорода. Это исключает большинство электрохимических пар, возникающих выше выходного напряжения 1,5 В, что ограничивает повышение плотности энергии полных устройств (Lu et al., 2011; Kim et al., 2014; Jiang et al., 2019a; Liu et al. ., 2020).
Недавно сообщалось, что высококонцентрированные электролиты «вода-в-соли» (WIS), в которых количество растворенных солей намного превышает количество молекул воды (соотношение соль/растворитель > 1 по объему или весу), расширяют окно стабильного напряжения вверх. до ~3.0 В (Суо и др., 2016, 2017). В электролитах ВИС все молекулы воды участвуют в ионных сольватных оболочках, и «свободных» остатков воды не бывает. В качестве типичной системы Suo et al. впервые разработал электролит высокой концентрации с 21 м (моль кг -1 ) бис(трифторметилсульфонил)имида лития (LiTFSI) для водных перезаряжаемых ЛИА (мольное отношение Li + к H 2 O равно 2,5) ( Ван и др., 2015). Однако экономические и экологические проблемы, а также редкость и растущее потребление литиевых ресурсов сдерживают масштабируемое применение электрохимических устройств на основе лития.Как следствие, разработка альтернативных водных аккумуляторных батарей на основе некоторых других распространенных в земле элементов оказывается актуальной и более значимой. Поэтому в последнее время интенсивно исследуются водные вторичные батареи на основе одновалентных (Na + , K + ) и/или поливалентных (Zn 2+ , Mg 2+ и Al 3+ ) катионов ( Wessells et al., 2011; Zhao et al., 2016; Suo et al., 2017; Wang et al., 2020).
впервые разработал электролит высокой концентрации с 21 м (моль кг -1 ) бис(трифторметилсульфонил)имида лития (LiTFSI) для водных перезаряжаемых ЛИА (мольное отношение Li + к H 2 O равно 2,5) ( Ван и др., 2015). Однако экономические и экологические проблемы, а также редкость и растущее потребление литиевых ресурсов сдерживают масштабируемое применение электрохимических устройств на основе лития.Как следствие, разработка альтернативных водных аккумуляторных батарей на основе некоторых других распространенных в земле элементов оказывается актуальной и более значимой. Поэтому в последнее время интенсивно исследуются водные вторичные батареи на основе одновалентных (Na + , K + ) и/или поливалентных (Zn 2+ , Mg 2+ и Al 3+ ) катионов ( Wessells et al., 2011; Zhao et al., 2016; Suo et al., 2017; Wang et al., 2020).
В этом мини-обзоре мы в основном затронули тему электролитов WIS и их последних достижений в различных нелитиевых водных перезаряжаемых металло-ионных батареях (ARMIB).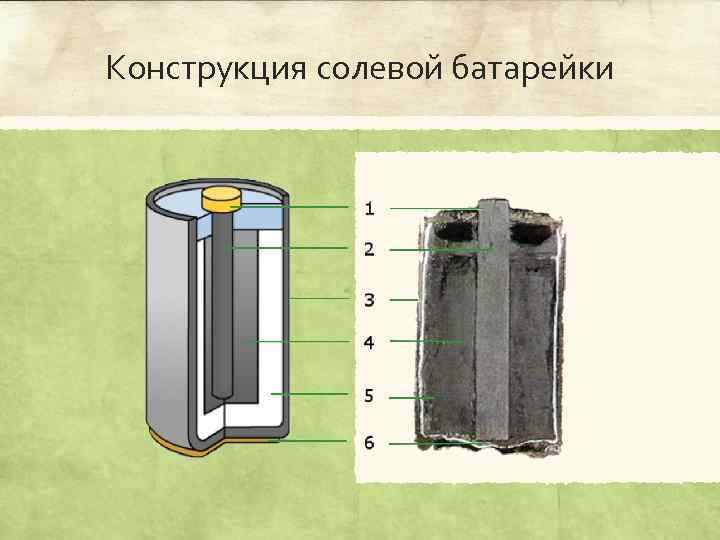 В первом разделе мы кратко рассмотрели задействованный механизм электролитов WIS в расширении окна напряжения электрохимической стабильности устройств. Затем мы представили обширный обзор применения электролитов WIS в водных нелитиевых вторичных батареях, включая водные натрий-ионные батареи (ASIB), водные калий-ионные батареи (APIB), водные цинк-ионные батареи (AZIB), водные магниево-ионные батареи (AMIB) и водные алюминий-ионные батареи (AAIB).Наконец, мы предложили существующие проблемы и перспективы будущего развития электролитов WIS в направлении усовершенствованных нелитиевых ARMIB.
В первом разделе мы кратко рассмотрели задействованный механизм электролитов WIS в расширении окна напряжения электрохимической стабильности устройств. Затем мы представили обширный обзор применения электролитов WIS в водных нелитиевых вторичных батареях, включая водные натрий-ионные батареи (ASIB), водные калий-ионные батареи (APIB), водные цинк-ионные батареи (AZIB), водные магниево-ионные батареи (AMIB) и водные алюминий-ионные батареи (AAIB).Наконец, мы предложили существующие проблемы и перспективы будущего развития электролитов WIS в направлении усовершенствованных нелитиевых ARMIB.
Рабочий механизм электролитов «WIS» в расширении электрохимического окна устройств
Общеизвестно, что доля свободной воды является одним из ключевых факторов, влияющих на электрохимическую стабильность электролитов (McEldrew et al., 2018; Ватаману, Бородин, 2018). В традиционных электролитах «соль в воде» (SIW) количество молекул воды значительно превышает количество солей, и они относительно свободно образуют сети водородных связей. Таким образом, большое количество молекул воды будет разделять или растворять (или разъедать) материал электрода (Dubouis et al., 2018; Huang et al., 2019a). С увеличением концентрации соли может образовываться более плотная сольватная оболочка, связанная с электролитами WIS. Между тем молекулы «свободного» водного растворителя проявляют меньшую подвижность. Они оказываются преимущественно сольватированными ионами металлов и поэтому менее доступны для разделения анионов соли. Соответственно, водородные связи вода-вода заменяются взаимодействиями вода-ион-связь, усиливая взаимодействие между катионами и анионами, что может еще больше расширить стабильные рабочие окна электролитов (Азов и др., 2018).
Таким образом, большое количество молекул воды будет разделять или растворять (или разъедать) материал электрода (Dubouis et al., 2018; Huang et al., 2019a). С увеличением концентрации соли может образовываться более плотная сольватная оболочка, связанная с электролитами WIS. Между тем молекулы «свободного» водного растворителя проявляют меньшую подвижность. Они оказываются преимущественно сольватированными ионами металлов и поэтому менее доступны для разделения анионов соли. Соответственно, водородные связи вода-вода заменяются взаимодействиями вода-ион-связь, усиливая взаимодействие между катионами и анионами, что может еще больше расширить стабильные рабочие окна электролитов (Азов и др., 2018).
Также считается, что образование межфазного слоя твердого электролита (SEI) с высокой концентрацией соли на поверхности электрода может предотвратить восстановление воды, тем самым положительно влияя на широкий диапазон электрохимической стабильности. В частности, OH —, образующийся во время реакции водорода с кислородом в первом цикле, будет химически реагировать с анионами (такими как TFSI) с образованием в основном стабильной пленки SEI, которая дополнительно предотвращает восстановление воды и повышает окислительную стабильность мастерство электродов (Coustan et al. , 2018; Дюбуи и др., 2018). Типичная структура сольватации электролитов WIS схематически изображена на схеме 1.
, 2018; Дюбуи и др., 2018). Типичная структура сольватации электролитов WIS схематически изображена на схеме 1.
Схема 1 . Схематическая диаграмма структуры сольватации электролитов WIS. Линруи Хоу и др.
Хорошо известно, что это эффективная стратегия повышения плотности энергии батарей за счет повышения рабочего напряжения (Xia et al., 2017; Manalastas et al., 2018). Напряжение, согласно следующему уравнению Нернста, сильно зависит от потенциалов полуэлементов как положительного, так и отрицательного электродов.
V=V0-RTnFln CaredCbox (2) где В 0 – стандартный восстановительный потенциал полуэлемента по отношению к стандартному водородному электроду (СВЭ), R – универсальная газовая постоянная, T – абсолютная температура в кельвинах, n – стехиометрическое число электронов, F – постоянная Фарадея, C красный – концентрация восстановленной формы, C ox – концентрация окисленной формы, b – экспоненциальные степени, определяемые коэффициентами C red и C ox в окислительно-восстановительной полуреакции соответственно.
Максимальный потенциал клетки (Δ В ) критически определяется вычитанием потенциала между положительным и отрицательным ( В 0 + — В 0 — ). Более высокая концентрация окисленной формы (C ox ) создает более сильные восстановительные потенциалы, как показано в уравнениях 1, 2. Концентрация электролита и пленка SEI могут эффективно контролировать разложение электролита, что позволяет окислительно-восстановительным ионам даже с более высокой концентрацией участвуют в электрохимических реакциях в расширенном окне электрохимического напряжения.Сообщается, что расчеты теории функционала плотности (DFT) являются эффективным способом расчета восстановительных потенциалов солей анионов (Suo et al., 2015; Dawut et al., 2019; Shin et al., 2019).
Электролиты WIS для нелитиевых кронштейнов
Принимая во внимание некоторые полученные обзоры о электролитах WIS в водных батареях на основе лития (Wang et al. , 2012; Kim et al., 2014), этот мини-обзор будет в основном сосредоточен на последних достижениях в области высококонцентрированных электролитов WIS для нелитиевых аккумуляторов. ARMIB, включая ASIB, APIB, AZIB, AMIB и AAIB.Электрохимические свойства этих батарей систематически собраны в Таблице 1.
, 2012; Kim et al., 2014), этот мини-обзор будет в основном сосредоточен на последних достижениях в области высококонцентрированных электролитов WIS для нелитиевых аккумуляторов. ARMIB, включая ASIB, APIB, AZIB, AMIB и AAIB.Электрохимические свойства этих батарей систематически собраны в Таблице 1.
Таблица 1 . Основные электрохимические свойства водных нелитиевых батарей на основе ВИС.
Хорошо известно, что электролиты как промежуточные продукты переноса ионов, с присущими им ионной проводимостью, подвижностью, межфазными характеристиками и другими свойствами, играют решающую роль в улучшении характеристик цикла. Разработка и оптимизация функционального электролита со стабильными границами раздела электрод/электролит должна рассматриваться как важный способ достижения превосходных электрохимических характеристик в батареях на водной основе.Типичные стратегии проектирования оптимизируются путем изменения компонентов электролита, включая соли и добавки (Peng et al. , 2017; Zhao et al., 2020).
, 2017; Zhao et al., 2020).
Выбор солей существенно влияет на электрохимическую стабильность электролитов, а также на их ионную проводимость и термическую стабильность. Анионы солей в водных электролитах WIS обычно можно разделить на неорганические (Cl — , SO42- и ClO4-) и органические (CF 3 SO3-, FSI — , TFSI — , BETI — и PTFSI —) (Hong et al., 2013; Чжан и др., 2020). Неорганические соли, вероятно, будут рассматриваться из-за их низкой стоимости и высокой ионной проводимости. Например, меньшее количество побочных реакций и низкая степень окисления Cl — делают его пригодным для водных электролитов (Zhang et al., 2018). В случае SO42- низкая стоимость, хорошая совместимость и исключительная стабильность делают его более привлекательным; однако некоторые побочные продукты, образующиеся в результате чрезмерного циклирования, по-прежнему ограничивают его практическое применение (Zhao et al., 2016; Huang et al. , 2019b).Еще одним анионом является ClO4-, который обладает сильной окисляемостью, что снижает риск взрыва и высокую токсичность (Lee et al., 2019). Объемные органические анионы (например, CF 3 SO3-, FSI —, TFSI —, BETI — и PTFSI —) в водных электролитах могут уменьшить эффект сольватации, занимая большое пространство. Эти анионы демонстрируют низкую ионную проводимость и проблемы с коррозией (Yamada et al., 2016; Jiang et al., 2019a; Pan et al., 2019).
, 2019b).Еще одним анионом является ClO4-, который обладает сильной окисляемостью, что снижает риск взрыва и высокую токсичность (Lee et al., 2019). Объемные органические анионы (например, CF 3 SO3-, FSI —, TFSI —, BETI — и PTFSI —) в водных электролитах могут уменьшить эффект сольватации, занимая большое пространство. Эти анионы демонстрируют низкую ионную проводимость и проблемы с коррозией (Yamada et al., 2016; Jiang et al., 2019a; Pan et al., 2019).
АСИБС
Натрий, как один из щелочных металлов, близко расположен к литию в таблице Менделеева и имеет относительно низкий электрохимический потенциал (-2.71 В против ОНА). Как правило, SIB имеют много общих химических свойств с LIB (Kim et al., 2012; Li et al., 2013; Boyd and Augustyn, 2018; Zheng et al., 2019). Высококонцентрированные электролиты WIS производят ASIB с лучшей стабильностью при циклировании. Однако легкая кристаллизация высококонцентрированных электролитов при комнатной температуре серьезно ограничит их практическое применение и даже повредит батареи (Wu et al. , 2015; Reber et al., 2019; Zhang et al., 2020). В настоящее время гидратные расплавы или бисоли, особенно применение асимметричных имид-анионов (таких как FTFSI и PTFSI), доказали свою эффективность для снижения вязкости и плотности, а также для сдерживания кристаллизации за счет нарушения структуры воды и/или изменения вероятности структур сольватации с агрегацией ионов (Marcus, 2009; Brini et al., 2017; Suo et al., 2017), что приводит к высокой растворимости солевых анионов (Suo et al., 2016; Zheng et al., 2019).
, 2015; Reber et al., 2019; Zhang et al., 2020). В настоящее время гидратные расплавы или бисоли, особенно применение асимметричных имид-анионов (таких как FTFSI и PTFSI), доказали свою эффективность для снижения вязкости и плотности, а также для сдерживания кристаллизации за счет нарушения структуры воды и/или изменения вероятности структур сольватации с агрегацией ионов (Marcus, 2009; Brini et al., 2017; Suo et al., 2017), что приводит к высокой растворимости солевых анионов (Suo et al., 2016; Zheng et al., 2019).
Как сообщалось в предыдущих работах, в электролитах АСИБ обычно используются соли NaClO 4 , NaFSI, NaCF 3 SO 3 (NaOTf) и NaTFSI из-за их уникальных свойств. Суо и др. впервые сообщили о проводящем слое SEI Na + на поверхности анода NaTi 2 (PO 4 ) 3 в электролите 9.26 м трифторметансульфоната натрия (NaCF 3 SO 3 или NaOTf), который расширяет окно электрохимической стабильности NaTi 2 (PO 4 ) 3 до 2,5 В (по сравнению с Na + Na) (Suo et al. , 2017). Кюнель и его сотрудники получили бис(фторсульфонил)имид натрия (NaFSI) сверхвысокой концентрации (до 37 М) в воде путем быстрого отверждения всего перенасыщенного раствора, обеспечивающего стабильное электрохимическое окно 2,6 В. Поразительно, водный раствор NaTi 2 (PO 4 ) 3 //Na 3 (VOPO 4 ) 2 F натрий-ионный аккумулятор с электролитом 35 мкМ NaFSI демонстрирует электрохимически обратимое поведение в пределах электрохимически обратимого окна 2.0 В (Kühnel et al., 2017). Также показано, что электролиты NaFSI с различными концентрациями эффективно расширяют диапазоны напряжений ASIB (Zheng et al., 2019). Другим широко используемым электролитом в ASIB является раствор NaClO 4 . Когда его моляльность увеличивается до 17 мкм, может быть реализовано окно стабильного электрохимического потенциала ~2,8 В (Nakamoto et al., 2017, 2018; Lee et al., 2019). Однако потенциальная взрывоопасность и высокая токсичность могут препятствовать широкому использованию NaClO 4 .
, 2017). Кюнель и его сотрудники получили бис(фторсульфонил)имид натрия (NaFSI) сверхвысокой концентрации (до 37 М) в воде путем быстрого отверждения всего перенасыщенного раствора, обеспечивающего стабильное электрохимическое окно 2,6 В. Поразительно, водный раствор NaTi 2 (PO 4 ) 3 //Na 3 (VOPO 4 ) 2 F натрий-ионный аккумулятор с электролитом 35 мкМ NaFSI демонстрирует электрохимически обратимое поведение в пределах электрохимически обратимого окна 2.0 В (Kühnel et al., 2017). Также показано, что электролиты NaFSI с различными концентрациями эффективно расширяют диапазоны напряжений ASIB (Zheng et al., 2019). Другим широко используемым электролитом в ASIB является раствор NaClO 4 . Когда его моляльность увеличивается до 17 мкм, может быть реализовано окно стабильного электрохимического потенциала ~2,8 В (Nakamoto et al., 2017, 2018; Lee et al., 2019). Однако потенциальная взрывоопасность и высокая токсичность могут препятствовать широкому использованию NaClO 4 . Батталья и др. исследовали натрий-ионный аккумулятор NaTi 2 (PO 4 ) 3 //Na 3 (VOPO 4 ) 2 F, используя смешанный электролит NaFSI/NaFTFSI (250 мкл NaFSI и НаФТФСИ). Уникальное устройство демонстрирует превосходные электрохимические характеристики с точки зрения циклической стабильности, обратимой емкости и плотности энергии в широком диапазоне рабочих температур от -10 до 30°C, чему способствует положительная роль смешанного электролита (Reber et al., 2019). Новый тип смешанных электролитов ВИС, содержащих инертные катионы (ТЭА + ), получают растворением трифторметансульфоната натрия (NaOTf) и трифторметансульфоната тетраэтиламмония (ТЭАОТf) в воде. При общей концентрации солей до 31 м (9 м NaOTf и 22 м TEAOTf) уникальный электролит NaOTf/TEAOTf обладает широким диапазоном напряжения ~3,3 В, а также подавляет растворение положительного переходного металла ( Цзян и др., 2019а).
Батталья и др. исследовали натрий-ионный аккумулятор NaTi 2 (PO 4 ) 3 //Na 3 (VOPO 4 ) 2 F, используя смешанный электролит NaFSI/NaFTFSI (250 мкл NaFSI и НаФТФСИ). Уникальное устройство демонстрирует превосходные электрохимические характеристики с точки зрения циклической стабильности, обратимой емкости и плотности энергии в широком диапазоне рабочих температур от -10 до 30°C, чему способствует положительная роль смешанного электролита (Reber et al., 2019). Новый тип смешанных электролитов ВИС, содержащих инертные катионы (ТЭА + ), получают растворением трифторметансульфоната натрия (NaOTf) и трифторметансульфоната тетраэтиламмония (ТЭАОТf) в воде. При общей концентрации солей до 31 м (9 м NaOTf и 22 м TEAOTf) уникальный электролит NaOTf/TEAOTf обладает широким диапазоном напряжения ~3,3 В, а также подавляет растворение положительного переходного металла ( Цзян и др., 2019а).
АПИБС
Калий-ионные батареи (PIB) также считаются многообещающей системой хранения энергии из-за их обильных ресурсов калия (Su et al.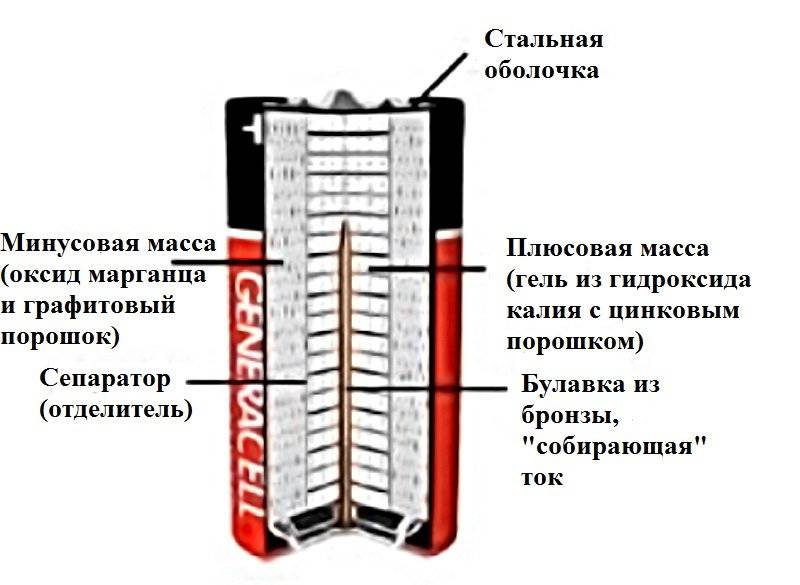 , 2016; Эфтехари и др., 2017). Как правило, калий обладает более низким стандартным окислительно-восстановительным потенциалом, чем его аналоги Na и Li, что гарантирует PIB с потенциально более высоким напряжением элемента. Однако более высокий потенциал ионизации и больший ионный радиус самого K ограничили выбор материалов электродов для усовершенствованных APIB (Suo et al., 2017; Hwang et al., 2018). Благодаря меньшему радиусу Стокса сольватированного K + из-за его слабой кислотности по Льюису и низкой межфазной реакционной стойкости из-за малой энергии активации десольватации, K-содержащие электролиты всегда демонстрируют более высокую проводимость, чем их Li/Na аналоги (Komaba и другие., 2015; Ким и др., 2017; Чен и др., 2020). Между тем слабая стойкость электролитов к окислению и недостаточная пассивация на поверхности отрицательных электродов приводит к скромным обратимым емкостям, особенно на начальном цикле или в высоковольтных (>4,0 В) рабочих окнах, что ограничивает огромное развитие APIB (Hosaka et al.
, 2016; Эфтехари и др., 2017). Как правило, калий обладает более низким стандартным окислительно-восстановительным потенциалом, чем его аналоги Na и Li, что гарантирует PIB с потенциально более высоким напряжением элемента. Однако более высокий потенциал ионизации и больший ионный радиус самого K ограничили выбор материалов электродов для усовершенствованных APIB (Suo et al., 2017; Hwang et al., 2018). Благодаря меньшему радиусу Стокса сольватированного K + из-за его слабой кислотности по Льюису и низкой межфазной реакционной стойкости из-за малой энергии активации десольватации, K-содержащие электролиты всегда демонстрируют более высокую проводимость, чем их Li/Na аналоги (Komaba и другие., 2015; Ким и др., 2017; Чен и др., 2020). Между тем слабая стойкость электролитов к окислению и недостаточная пассивация на поверхности отрицательных электродов приводит к скромным обратимым емкостям, особенно на начальном цикле или в высоковольтных (>4,0 В) рабочих окнах, что ограничивает огромное развитие APIB (Hosaka et al. , 2018). Следовательно, важно подобрать APIB высокой энергии для целенаправленного изучения подходящих электролитов.
, 2018). Следовательно, важно подобрать APIB высокой энергии для целенаправленного изучения подходящих электролитов.
Леонард и его коллеги впервые сообщили о водном электролите 30 м ацетата калия (KAc) для APIB (Leonard et al., 2018). С электролитом анод KTi 2 (PO 4 ) 3 (KTP) демонстрирует хорошие обратимые характеристики в расширенном электрохимическом окне от -1,7 до 1,5 В (по сравнению с Ag/AgCl). По сравнению с электролитами на основе KAc и LiTFSI с той же концентрацией электролиты на основе бис(фторсульфонил)имида (KFSI) обладают более высокой проводимостью (Chen et al., 2020). Электролит 30 м KFSI также демонстрирует окно электрохимической стабильности от -1,55 до 2,42 В (по сравнению с Hg/Hg 2 Cl 2 ), что позволяет b -перилен-3,4,9,10- тетракарбоновый диангидрид ( b -PTCDA) и даже полные батареи на основе b -PTCDA для стабильной работы в таких высококонцентрированных электролитах без выделения водорода и растворения материала (Chen et al. , 2020). Цзян и др. исследовали также водный диимид 3,4,9,10-перилентетракарбоновой кислоты (анод)//К 1,85 Fe 0,33 Mn 0,67 [Fe(CN) 6 ] 1 0,90 7 O 902 ·0,98 (катод) полное устройство с 20-метровым электролитом KCF 3 SO 3 (KOTf) WIS, и полная батарея демонстрирует беспрецедентную производительность с точки зрения обратимой емкости и скоростей (Jiang et al., 2019b).
, 2020). Цзян и др. исследовали также водный диимид 3,4,9,10-перилентетракарбоновой кислоты (анод)//К 1,85 Fe 0,33 Mn 0,67 [Fe(CN) 6 ] 1 0,90 7 O 902 ·0,98 (катод) полное устройство с 20-метровым электролитом KCF 3 SO 3 (KOTf) WIS, и полная батарея демонстрирует беспрецедентную производительность с точки зрения обратимой емкости и скоростей (Jiang et al., 2019b).
Сообщалось, что асимметричные гидратные расплавы с оптимизированной эвтектической системой представляют собой стабильный водный электролит с хорошей текучестью и пониженной вязкостью/плотностью, в котором все молекулы воды участвуют в гидратных оболочках Li + (Yamada et al., 2016). С введенным стабильным асимметричным анионом (т.е. PTFSI —) K(PTFSI) 0,12 (TFSI) 0,08 (OTf) 0,8 ·2H 2 O при плавлении щелочи проявляет превосходную растворимость в воде и расширенное рабочее окно ~ 2,5 В (~ 2,14–4,65 В по сравнению с K + / K), но не страдает от уязвимой связи SF. При этом ионная проводимость K(PTFSI) 0,12 (TFSI) 0,08 (OTf) 0,8 2H 2 O поддерживается на уровне ~34.6 мСм см -1 , что намного выше, чем у других типичных неводных электролитов (~ 10 мСм см -1 ) (Zheng et al., 2019).
При этом ионная проводимость K(PTFSI) 0,12 (TFSI) 0,08 (OTf) 0,8 2H 2 O поддерживается на уровне ~34.6 мСм см -1 , что намного выше, чем у других типичных неводных электролитов (~ 10 мСм см -1 ) (Zheng et al., 2019).
АЗИБС
В последнее время AZIB из-за их замечательной термической стабильности, высокой теоретической удельной емкости (~820 мАч·г -1 ), искробезопасности и низкой стоимости металлического Zn считаются наиболее многообещающей альтернативой ЛИА. Более того, металлический Zn стабилен и может непосредственно использоваться в качестве электрохимически обратимого анода в водных электролитах (Zhang, 1996; Li et al., 2019). Однако его широкое применение по-прежнему ограничено подходящими водными электролитами с отличными термическими свойствами и безопасностью. Предыдущие работы показали, что щелочные водные электролиты приводят к образованию дендритов цинка и побочного продукта ZnO, вызывая плохую циклическую емкость и низкие значения CE (Zhang et al. , 2014; Wang et al., 2018a). Точно так же нейтральные или слабокислые электролиты на основе солей цинка с высокой концентрацией являются очень эффективным способом решения этих проблем.
, 2014; Wang et al., 2018a). Точно так же нейтральные или слабокислые электролиты на основе солей цинка с высокой концентрацией являются очень эффективным способом решения этих проблем.
Как правило, растворы ZnSO 4 и Zn(CF 3 SO 3 ) 2 обычно используются в качестве электролитов для AZIB из-за их превосходной стабильности и совместимости (Song et al., 2018). Чжао и др. собрал Zn//LiMn 0,8 Fe 0,2 PO 4 водный гибридно-ионный аккумулятор с 0,5 м ZnSO 4 и 21 м LiTFSI в качестве электролита WIS. Уникальное устройство обеспечивает высокую плотность энергии ~183 Втч·кг −1 и высокое рабочее напряжение, превышающее 1.8 В (Чжао и др., 2016). Однако электролит ZnSO 4 для AZIB всегда имеет недостатки из-за ограниченной растворимости и более низкой эффективности извлечения/осаждения Zn. Напротив, электролит Zn(CF 3 SO 3 ) 2 демонстрирует меньшую поляризацию и более высокие значения CE, что делает его пригодным для широкого применения в водных ZIB (Huang et al. , 2019b; Xie et al., 2020). Группа Мэя разработала новую гибридно-ионную батарею Zn//V 2 O 5 на водной основе с электролитом WIS из 1 м Zn (CF 3 SO 3 ) 2 и 21 м LiTFSI.По сравнению с Zn(CF 3 SO 3 ) 2 (1 м), батарея Zn//V 2 O 5 с WIS-электролитом (21 м LiTFSI и 1 м Zn (CF 3 SO 3 ) 2 ) продемонстрировали более стабильное плато заряда/разряда и цикличность (Hu et al., 2017). Кроме того, благодаря большим размерам анионов TFSI — Zn(TFSI) 2 в качестве новой органической соли цинка может эффективно снижать эффект сольватации. Группа Вана разработала электролит WIS из 1 м Zn(TFSI) 2 + 20 м LiTFSI, который способен удерживать воду в открытой атмосфере.Он эффективно способствует нанесению покрытия/удалению металлического Zn без дендритов с почти 100% CE и обеспечивает беспрецедентную обратимость водных ZIB с катодами LiMn 2 O 4 или O 2 (Wang et al.
, 2019b; Xie et al., 2020). Группа Мэя разработала новую гибридно-ионную батарею Zn//V 2 O 5 на водной основе с электролитом WIS из 1 м Zn (CF 3 SO 3 ) 2 и 21 м LiTFSI.По сравнению с Zn(CF 3 SO 3 ) 2 (1 м), батарея Zn//V 2 O 5 с WIS-электролитом (21 м LiTFSI и 1 м Zn (CF 3 SO 3 ) 2 ) продемонстрировали более стабильное плато заряда/разряда и цикличность (Hu et al., 2017). Кроме того, благодаря большим размерам анионов TFSI — Zn(TFSI) 2 в качестве новой органической соли цинка может эффективно снижать эффект сольватации. Группа Вана разработала электролит WIS из 1 м Zn(TFSI) 2 + 20 м LiTFSI, который способен удерживать воду в открытой атмосфере.Он эффективно способствует нанесению покрытия/удалению металлического Zn без дендритов с почти 100% CE и обеспечивает беспрецедентную обратимость водных ZIB с катодами LiMn 2 O 4 или O 2 (Wang et al. , 2018a). . Кроме того, новый недорогой электролит WIS из 30 м ZnCl 2 может обеспечить широкое электрохимическое окно 2,3 В из-за меньшего количества побочных реакций и низкой окислительной способности Cl — (Zhang et al., 2018). В симметричной ячейке Zn||Zn с 30 мкм электролитом ZnCl 2 цинковый электрод обеспечивает высокий КЭ, равный 95.4% и высокостабильный профиль гальваностатического заряда-разряда более 600 часов без каких-либо значительных колебаний перенапряжения (Zhang et al., 2018).
, 2018a). . Кроме того, новый недорогой электролит WIS из 30 м ZnCl 2 может обеспечить широкое электрохимическое окно 2,3 В из-за меньшего количества побочных реакций и низкой окислительной способности Cl — (Zhang et al., 2018). В симметричной ячейке Zn||Zn с 30 мкм электролитом ZnCl 2 цинковый электрод обеспечивает высокий КЭ, равный 95.4% и высокостабильный профиль гальваностатического заряда-разряда более 600 часов без каких-либо значительных колебаний перенапряжения (Zhang et al., 2018).
АМИБС
Многовалентные ионы, будучи хорошими переносчиками, могут переносить больше электронов, чем одновалентные ионы. Помимо Zn 2+ , другой двухвалентный ион металла Mg 2+ с низким восстановительным потенциалом (-2,37 В) также считается преобладающим носителем заряда для AMIB из-за высокой объемной удельной емкости Mg (~ 3833 мАч). L -1 ) и общий лакк роста дендритов (Rasul et al., 2012; Сонг и др., 2015; Сюй и др. , 2015; Сан и др., 2016). Текущая разработка и практическое применение электролитов для AMIB ограничены коррозией электролитов (Wang et al., 2017; Zhao et al., 2020). Электрохимическое растворение Mg происходит при высоком перенапряжении, что ограничивает выбор растворителей (Hebié et al., 2017). Следовательно, обычно используемые анионы (Cl — , SO42-, ClO4-, CF 3 SO3-) в других ARMIB не могут быть непосредственно применены к AMIB.Более того, высокая плотность заряда многовалентных ионов будет вызывать сильные кулоновские взаимодействия как с решеткой электролитов-растворителей, так и с электродными материалами, что является неблагоприятным фактором для улучшения электрохимических характеристик (Lapidus et al., 2014; Wang et al., 2018b). Пока что AMIB все еще находятся в зачаточном состоянии; только несколько возможных материалов на основе электролитов WIS демонстрируют обратимые характеристики по отношению к AMIB.
, 2015; Сан и др., 2016). Текущая разработка и практическое применение электролитов для AMIB ограничены коррозией электролитов (Wang et al., 2017; Zhao et al., 2020). Электрохимическое растворение Mg происходит при высоком перенапряжении, что ограничивает выбор растворителей (Hebié et al., 2017). Следовательно, обычно используемые анионы (Cl — , SO42-, ClO4-, CF 3 SO3-) в других ARMIB не могут быть непосредственно применены к AMIB.Более того, высокая плотность заряда многовалентных ионов будет вызывать сильные кулоновские взаимодействия как с решеткой электролитов-растворителей, так и с электродными материалами, что является неблагоприятным фактором для улучшения электрохимических характеристик (Lapidus et al., 2014; Wang et al., 2018b). Пока что AMIB все еще находятся в зачаточном состоянии; только несколько возможных материалов на основе электролитов WIS демонстрируют обратимые характеристики по отношению к AMIB.
Кроме того, Mg(TFSI) 2 в качестве нейтральной молекулы полностью не вызывает коррозии, безопасен и экологически чист, и его можно ожидать для применения в AMIB (Yoo et al. , 2013). Ван и др. изготовили полипиромеллитовый диангидрид//Li 3 V 2 (PO 4 ) 3 с использованием 4 м Mg(TFSI) 2 в качестве электролита. Полная ячейка демонстрирует превосходные электрохимические свойства, включая превосходную скорость, высокую плотность мощности и сохранение высокой емкости в электрохимическом окне 1,9 В (Wang et al., 2017).
, 2013). Ван и др. изготовили полипиромеллитовый диангидрид//Li 3 V 2 (PO 4 ) 3 с использованием 4 м Mg(TFSI) 2 в качестве электролита. Полная ячейка демонстрирует превосходные электрохимические свойства, включая превосходную скорость, высокую плотность мощности и сохранение высокой емкости в электрохимическом окне 1,9 В (Wang et al., 2017).
ААИБС
Алюминий является первым широко распространенным металлическим элементом в земной коре, который широко исследовался в качестве материала анода для AAIB (Wang et al., 2016). Более того, ионный радиус Al 3+ (0,054 нм) намного меньше, чем у Li + (0,076 нм), что обеспечивает быстрое внедрение/выведение Al 3+ в процессе заряда/разряда (Rudd and Gibbons, 1994; Li et al., 2007; Das et al., 2017; Yang et al., 2019b). Кроме того, алюминиевый анод обладает большой гравиметрической/объемной емкостью (~2980 мА·ч·г -1 /~8,046 мА·ч·см -3 ) благодаря своей уникальной способности переноса трех электронов. Однако низкая ионная проводимость, коррозия при использовании электролитов с низкой концентрацией и рост дендритов по-прежнему ограничивают электрохимическую стабильность электролитов, тем самым ограничивая их крупномасштабное применение в энергетике (Liu et al., 2012; Накаяма и др., 2015; Чжао и др., 2018). Таким образом, ключом к разработке AAIB является использование электролитов WIS для получения высокоэффективных электродов, которые могут растворять дендриты, тем самым значительно улучшая стабильность при циклировании.
Однако низкая ионная проводимость, коррозия при использовании электролитов с низкой концентрацией и рост дендритов по-прежнему ограничивают электрохимическую стабильность электролитов, тем самым ограничивая их крупномасштабное применение в энергетике (Liu et al., 2012; Накаяма и др., 2015; Чжао и др., 2018). Таким образом, ключом к разработке AAIB является использование электролитов WIS для получения высокоэффективных электродов, которые могут растворять дендриты, тем самым значительно улучшая стабильность при циклировании.
AlCl 3 , благодаря сверхнизкой стоимости и безопасности, широко используется в качестве электролитов для AAIB. Пан и др. сообщили о высококонцентрированном водном растворе AlCl 3 (3,382 м) в качестве электролита для нового водного аккумулятора Al/AlCl 3 /графита, который может стабильно работать в пределах окна электрохимической стабильности ~4 В и демонстрирует большую емкость ~165 при 500 мА г -1 наряду с высоким CE 95% в течение 1000 циклов (Pan et al. , 2019). Кроме того, Al(OTf) 3 — это еще один тип электролита с некоррозионными свойствами, что делает его более предпочтительным, чем коррозионный AlCl 3 , при применении в AAIB (Das et al., 2017). Группа Чена представила электролит из 5 м Al (OTf) 3 для электрохимической оценки катода типа аналогов берлинской лазури FeFe (CN) 6 (FF-PBA). Примечательно, что с электролитом FF-PBA демонстрирует необычайно высокую начальную разрядную емкость ~116 мА·ч·г −1 и длительный срок службы с потерей емкости, равной 0.39% за цикл в расширенном рабочем окне 2,65 В (Zhou et al., 2019). До сих пор сообщалось о нескольких других электролитах WIS для AAIB.
, 2019). Кроме того, Al(OTf) 3 — это еще один тип электролита с некоррозионными свойствами, что делает его более предпочтительным, чем коррозионный AlCl 3 , при применении в AAIB (Das et al., 2017). Группа Чена представила электролит из 5 м Al (OTf) 3 для электрохимической оценки катода типа аналогов берлинской лазури FeFe (CN) 6 (FF-PBA). Примечательно, что с электролитом FF-PBA демонстрирует необычайно высокую начальную разрядную емкость ~116 мА·ч·г −1 и длительный срок службы с потерей емкости, равной 0.39% за цикл в расширенном рабочем окне 2,65 В (Zhou et al., 2019). До сих пор сообщалось о нескольких других электролитах WIS для AAIB.
Заключение
Электролиты, являющиеся промежуточными продуктами переноса ионов с присущей им ионной проводимостью, подвижностью, межфазными характеристиками и другими свойствами, играют решающую роль в улучшении характеристик цикла, емкости и безопасности аккумуляторов. Электролиты WIS с высококонцентрированными растворами солей, в частности, могут расширять окна электрохимического потенциала водных устройств примерно до 3 В и приводить к низкой активности растворителя (молекул воды) и высокой химической стабильности (сдерживание побочных реакций).Кроме того, образование стабильной пленки SEI также наделяет клетки высокой плотностью энергии и отличной циклической устойчивостью. Этот мини-обзор в основном посвящен электролитам WIS для ARMIB и обобщает недавнее исследование электролитов WIS в нелитиевых одновалентных (Na, K) и мультивалентных (Zn, Mg, Al) ионных батареях.
Электролиты WIS с высококонцентрированными растворами солей, в частности, могут расширять окна электрохимического потенциала водных устройств примерно до 3 В и приводить к низкой активности растворителя (молекул воды) и высокой химической стабильности (сдерживание побочных реакций).Кроме того, образование стабильной пленки SEI также наделяет клетки высокой плотностью энергии и отличной циклической устойчивостью. Этот мини-обзор в основном посвящен электролитам WIS для ARMIB и обобщает недавнее исследование электролитов WIS в нелитиевых одновалентных (Na, K) и мультивалентных (Zn, Mg, Al) ионных батареях.
Тем не менее, исследования, основанные на электролитах WIS, все еще находятся на начальной стадии, в соответствии с достижениями, о которых сообщалось до сих пор; Проблемы и перспективы будущего развития электролитов WIS в сторону нелитиевых ARMIB предлагаются следующим образом.Во-первых, научная основа для высококонцентрированных электролитов WIS представит некоторые новые, но неизвестные концепции, которые могут противоречить текущим классическим теориям, и должны быть дополнительно раскрыты с помощью элегантного сочетания спектроскопических методов in/ex-situ и теоретических моделирование/расчет. Например, необходимо всесторонне изучить внутренний ионный транспорт и механизмы функционального образования SEI в электролите WIS, которые отличаются от обычных систем SIW.Во-вторых, дальнейшее изучение соответствующих солей, особенно с высокой термодинамической стабильностью, суперионной проводимостью и хорошей совместимостью с обоими электродами при низкой стоимости, также следует учитывать для высокоэффективных электролитов WIS, учитывая их практическое коммерческое применение. В-третьих, также необходимо найти баланс между электролитами высокой концентрации и низкой вязкостью и кристаллизацией.
Например, необходимо всесторонне изучить внутренний ионный транспорт и механизмы функционального образования SEI в электролите WIS, которые отличаются от обычных систем SIW.Во-вторых, дальнейшее изучение соответствующих солей, особенно с высокой термодинамической стабильностью, суперионной проводимостью и хорошей совместимостью с обоими электродами при низкой стоимости, также следует учитывать для высокоэффективных электролитов WIS, учитывая их практическое коммерческое применение. В-третьих, также необходимо найти баланс между электролитами высокой концентрации и низкой вязкостью и кристаллизацией.
Несмотря на огромные трудности и проблемы, мы твердо верим, что водные перезаряжаемые батареи на основе электролитов WIS получат быстрое и устойчивое развитие в ближайшем будущем.Это приведет к появлению новых возможностей для будущего ландшафта хранения энергии.
Вклад авторов
YW: формальный анализ, расследование, написание — первоначальный проект и написание — обзор и редактирование. ХМ: расследование. JS: формальный анализ и написание — обзор и редактирование. YL: визуализация и программное обеспечение. LH: формальный анализ, исследование, концептуализация, написание — обзор и редактирование, получение финансирования. Все авторы внесли свой вклад в статью и одобрили представленную версию.
ХМ: расследование. JS: формальный анализ и написание — обзор и редактирование. YL: визуализация и программное обеспечение. LH: формальный анализ, исследование, концептуализация, написание — обзор и редактирование, получение финансирования. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
Эта работа была поддержана Национальным фондом естественных наук Китая (№№ 51772131, 51802119), Фондом докторантуры естественных наук провинции Шаньдун (ZR2019BEM038, ZR2019BB057) и Фондом докторантуры естественных наук Цзинаньского университета (XBS1830).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Ссылки
Азов В.А., Егорова К.С., Сейткалиева М.М., Кашин А.С., Анаников В.П. (2018). Системы «растворитель в соли» для создания новых материалов в химии, биологии и энергетических исследованиях. Хим. соц. Ре. 47, 1250–1284. дои: 10.1039/c7cs00547d
Хим. соц. Ре. 47, 1250–1284. дои: 10.1039/c7cs00547d
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Баскар, С., Мейрик, Д., Калаи Селван, Р., и Минакши, М. (2014). Легкий и крупномасштабный синтез альфа-CoMoO4 при сжигании: имитирует окислительно-восстановительное поведение батареи в водном гибридном устройстве. Хим. англ. Дж. 253, 502–507. doi: 10.1016/j.cej.2014.05.068
Полнотекстовая перекрестная ссылка | Академия Google
Бойд, С., и Августин, В. (2018). Оксиды переходных металлов для водного электрохимического накопления энергии ионами натрия. Неорг. хим. Фронт. 5, 999–1015. дои: 10.1039/c8qi00148k
Полнотекстовая перекрестная ссылка | Академия Google
Брини Э., Феннелл С. Дж., Фернандес-Серра М., Хрибар-Ли Б., Лукшич М. и Дилл К. А. (2017). Как свойства воды закодированы в ее молекулярной структуре и энергии. Хим. Ред. 117, 12385–12414. doi: 10.1021/acs.~chemrev.7b00259.
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Chen, H., Zhang, Z.Y., Wei, Z.X., Chen, G., Yang, X., Wang, C.Z., et al. (2020). Использование водно-солевого электролита для предотвращения растворения органических материалов и улучшения кинетики водных калийно-ионных батарей. Стойкость. Энергетическое топливо 4, 128–131. дои: 10.1039/c9se00545e
Полнотекстовая перекрестная ссылка | Академия Google
Кустан, Л., Загиб, К., и Беланже, Д. (2018). Новый взгляд на электрохимическое поведение электрода из нержавеющей стали в электролите вода-в-соли. J. Источники питания 399, 299–303. doi: 10.1016/j.jpowsour.2018.07.114
Полнотекстовая перекрестная ссылка | Академия Google
Дас С.К., Махапатра С. и Лахан Х. (2017). Алюминий-ионные аккумуляторы: разработки и проблемы. Дж. Матер. хим. А 5, 6347–6367. дои: 10.1039/c7ta00228a
Полнотекстовая перекрестная ссылка | Академия Google
Давут, Г. , Лу Ю., Мяо Л. К. и Чен Дж. (2019). Высокопроизводительные перезаряжаемые водные цинк-ионные батареи с поли(бензохинонилсульфидным) катодом. Неорг. хим. Фронт. 5, 1391–1396. дои: 10.1039/c8qI00197a
, Лу Ю., Мяо Л. К. и Чен Дж. (2019). Высокопроизводительные перезаряжаемые водные цинк-ионные батареи с поли(бензохинонилсульфидным) катодом. Неорг. хим. Фронт. 5, 1391–1396. дои: 10.1039/c8qI00197a
Полнотекстовая перекрестная ссылка | Академия Google
Дюбуи, Н., Лемер, П., Мирво, Б., Салагер, Э., Дешам, М., и Гримо, А. (2018). Роль реакции выделения водорода в механизме межфазного образования твердого электролита для электролитов типа «вода в соли». Энергетика Окружающая среда.науч. 11, 3491–3499. дои: 10.1039/c8ee02456a
Полнотекстовая перекрестная ссылка | Академия Google
Hebié, S., Ngo, H.P.K., Leprêtre, J.C., Iojoiu, C., Cointeaux, L., Berthelot, R., et al. (2017). Электролит на основе легко синтезируемой недорогой трифенолят-боргидридной соли для высокоэффективных Mg(TFSI) 2 -глимовых перезаряжаемых магниевых аккумуляторов. Приложение ACS Матер. Интерфейсы 9, 28377–28385. doi: 10.1021/acsami.7b06022
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хонг, С. Ю., Ким Ю., Пак Ю., Чой А., Чой Н. и Ли К. Т. (2013). Носители заряда в перезаряжаемых батареях: ионы Na против ионов Li. Энергетика Окружающая среда. науч. 6, 2067–2081. дои: 10.1039/c3ee40811f
Ю., Ким Ю., Пак Ю., Чой А., Чой Н. и Ли К. Т. (2013). Носители заряда в перезаряжаемых батареях: ионы Na против ионов Li. Энергетика Окружающая среда. науч. 6, 2067–2081. дои: 10.1039/c3ee40811f
Полнотекстовая перекрестная ссылка | Академия Google
Хосака Т., Кубота К., Кодзима Х. и Комаба С. (2018). Высококонцентрированные растворы электролитов для калий-ионных аккумуляторов класса 4 В. Хим. Комм. 54, 8387–8390. дои: 10.1039/c8cc04433c
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ху, П., Yan, M.Y., Zhu, T., Wang, X.P., Wei, X.J., Li, J.T., et al. (2017). Zn/V 2 O 5 Гибридно-ионная батарея на водной основе с высоковольтной платформой и длительным сроком службы. Приложение ACS Матер. Интерфейсы 9, 42717–42722. дои: 10.1021/acsami.7b13110
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хуанг, Дж. Х., Го, З. В., Ма, Ю. Ю., Бин, Д., Ван, Ю. Г., и Ся, Ю. Г. (2019a). Недавний прогресс аккумуляторных батарей с использованием мягких водных электролитов. Малые методы 3:1800272. doi: 10.1002/smtd.201800272
Г., и Ся, Ю. Г. (2019a). Недавний прогресс аккумуляторных батарей с использованием мягких водных электролитов. Малые методы 3:1800272. doi: 10.1002/smtd.201800272
Полнотекстовая перекрестная ссылка | Академия Google
Хван, Дж.-Ю., Мён, С.-Т., и Сун, Ю.-К. (2018). Недавний прогресс в перезаряжаемых калиевых батареях. Доп. Веселье. Матер. 28:1802938. doi: 10.1002/adfm.201802938
Полнотекстовая перекрестная ссылка | Академия Google
Jiang, L.W., Liu, L.L., Yue, J.M., Zhang, Q.Q., Zhou, A.X., Borodin, O., et al. (2019а). Высоковольтная водная натрий-ионная батарея с водно-солевым электролитом с инертным катионом. Доп. Матер. 32:17. doi: 10.1002/adma.2017
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Jiang, L.W., Lu, Y.X., Zhao, C.L., Liu, L.L., Zhang, J.N., Zhang, Q.Q., et al. (2019б). Создание водных K-ионных батарей для хранения энергии. Нац. Энергия 4, 495–503. doi: 10.1038/s41560-019-0388-0
doi: 10.1038/s41560-019-0388-0
Полнотекстовая перекрестная ссылка | Академия Google
Кандхасами, С., Пандей, А., и Минакши, М. (2012). Золь-гель с добавлением поливинилпирролидона LiCo 1/ 3Mn 1/3 Ni 1/3 PO 4 композитный катод для аккумуляторной батареи на водной основе. Электрохим. Acta 60, 170–176. doi: 10.1016/j.electacta.2011.11.028
Полнотекстовая перекрестная ссылка | Академия Google
Ким Х., Хонг Дж., Пак К.-Ю., Ким Х., Ким С.-В. и Канг К. (2014). Водные перезаряжаемые ионно-литиевые и натриевые батареи. Хим. Ред. 114, 11788–11827. дои: 10.1021/cr500232y
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ким, Х., Ким, Дж. К., Бьянчини, М., Сео, Д.-Х., Родригес-Гарсия, Дж., и Седер, Г.(2017). Недавний прогресс и перспективы в электродных материалах для K-ионных аккумуляторов. Доп. Энергия Матер. 8:1702384. doi: 10.1002/aenm.201702384
Полнотекстовая перекрестная ссылка | Академия Google
Ким С. -В., Сео Д.-Х., Ма Х.Х., Седер Г. и Канг К. (2012). Электродные материалы для перезаряжаемых натрий-ионных аккумуляторов: потенциальные альтернативы современным литий-ионным аккумуляторам. Доп. Энергия Матер. 2, 710–721. doi: 10.1002/aenm.201200026
-В., Сео Д.-Х., Ма Х.Х., Седер Г. и Канг К. (2012). Электродные материалы для перезаряжаемых натрий-ионных аккумуляторов: потенциальные альтернативы современным литий-ионным аккумуляторам. Доп. Энергия Матер. 2, 710–721. doi: 10.1002/aenm.201200026
Полнотекстовая перекрестная ссылка | Академия Google
Комаба, С., Хасэгава, Т., Дахби, М., и Кубота, К. (2015). Интеркаляция калия в графит для создания высоковольтных/мощных калий-ионных аккумуляторов и калий-ионных конденсаторов. Электрохим. коммун. 60, 172–175. doi: 10.1016/j.elecom.2015.09.002
Полнотекстовая перекрестная ссылка | Академия Google
Кюнель, Р. С., Ребер, Д., и Батталья, К. (2017). Высоковольтный водный электролит для натрий-ионных аккумуляторов. ACS Energy Письмо. 2, 2005–2006 гг. doi: 10.1021/acsenergylett.7b00623
Полнотекстовая перекрестная ссылка | Академия Google
Лапидус, С. Х., Раджпут, Н. Н., Ку, X., Чепмен, К. В., Перссон, К. А. , и Чупас, П. Дж. (2014). Сольватационная структура и энергетика электролитов для многовалентного накопления энергии. Физ. хим. хим. физ. 16, 21941–21945. дои: 10.1039/c4cp03015j
, и Чупас, П. Дж. (2014). Сольватационная структура и энергетика электролитов для многовалентного накопления энергии. Физ. хим. хим. физ. 16, 21941–21945. дои: 10.1039/c4cp03015j
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Lee, M.H., Kim, S.J., Chang, D.H., Kim, J.S., Moon, S., Oh, K., et al. (2019).На пути к недорогой высоковольтной натриевой водной аккумуляторной батарее. Матер. Сегодня 29, 26–36. doi: 10.1016/j.mattod.2019.02.004
Полнотекстовая перекрестная ссылка | Академия Google
Леонард, Д. П., Вэй, З. X., Чен, Г., Ду, Ф., и Цзи, X. Л. (2018). Водно-солевой электролит для калий-ионных аккумуляторов. ACS Energy Письмо. 3, 373–374. doi: 10.1021/acsenergylett.8b00009
Полнотекстовая перекрестная ссылка | Академия Google
Ли, К. С., Цзи, В. К., Чен, Дж.и Тао, З.Л. (2007). Металлические алюминиевые наностержни: синтез методом осаждения из паровой фазы и применение в алюминиево-воздушных батареях. Хим. Матер. 19, 5812–5814. doi: 10.1021/см7018795
Хим. Матер. 19, 5812–5814. doi: 10.1021/см7018795
Полнотекстовая перекрестная ссылка | Академия Google
Li, X.L., Ma, L.T., Zhao, Y.W., Yang, Q., Wang, D.H., Huang, Z.D., et al. (2019). Гидратированные гибридные нанопроволоки оксида ванадия в качестве превосходного катода для водной цинковой батареи. Матер. Сегодня Энергия 14:100361. doi: 10.1016/j.mtener.2019.100361
Полнотекстовая перекрестная ссылка | Академия Google
Li, Z., Young, D., Xiang, K., Carter, W.C., and Chiang, Y.-M. (2013). На пути к высокомощным высокоэнергетическим водным натрий-ионным батареям: система NaTi 2 (PO 4 ) 3 /Na 0,44 MnO 2 . Доп. Энергия Матер. 3, 290–294. doi: 10.1002/aenm.201200598
Полнотекстовая перекрестная ссылка | Академия Google
Лю, К., Чи, X. В., Хань, К., и Лю, Ю. (2020). Аккумулятор на водной основе с высокой плотностью энергии достигается за счет двойной реакции растворения/осаждения, разделенной в кислотно-щелочном электролите. Доп. Энергия Матер. 10:19. doi: 10.1002/aenm.2019
Доп. Энергия Матер. 10:19. doi: 10.1002/aenm.2019
Полнотекстовая перекрестная ссылка | Академия Google
Лю, С., Ху, Дж. Дж., Ян, Н. Ф., Пан, Г. Л., Ли, Г. Р., и Гао, X. П. (2012). Хранение алюминия массивами нанотрубок анатаза TiO 2 в водном растворе для алюминий-ионных аккумуляторов. Энергетика Окружающая среда. науч. 5, 9743–9746. дои: 10.1039/c2ee22987k
Полнотекстовая перекрестная ссылка | Академия Google
Лукацкая М.Р., Фельдблюм Ю.В.И., Маканик Д.Г., Лиссел Ф., Михельс Д.Л., Куи Ю. и др. (2018). Концентрированные смешанные ацетатно-катионные растворы «вода-в-соли» в качестве экологичных и недорогих высоковольтных электролитов для водных аккумуляторов. Энергетика Окружающая среда. науч. 11, 2876–2883. дои: 10.1039/c8ee00833g
Полнотекстовая перекрестная ссылка | Академия Google
Маналастас В. Дж., Кумар С., Верма В., Чжан Л. П., Юань Д. и Шринивасан М. (2018). Вода в перезаряжаемых поливалентных ионах: электрохимический ящик Пандоры. ХимСусХим. 12, 379–396. doi: 10.1002/cssc.201801523
ХимСусХим. 12, 379–396. doi: 10.1002/cssc.201801523
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
МакЭлдрю М., Гудвин З.А.Х., Корнышев А.А. и Базант М.З. (2018). Теория двойного слоя водно-солевых электролитов. J. Phys. хим. лат. 9, 5840–5846. doi: 10.1021/acs.jpclett.8b02543
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Накамото К., Сакамото Р., Ито М., Китаджоу А.и Окада, С. (2017). Влияние концентрированного электролита на водный натрий-ионный аккумулятор с катодом из гексацианоферрата натрия-марганца. Электрохим. 85, 179–185. doi: 10.5796/electrochemistry.85.179
Полнотекстовая перекрестная ссылка | Академия Google
Накамото К., Сакамото Р., Савада Ю. К., Ито М. и Окада С. (2018). Водная натрий-ионная батарея более 2 В с электродами типа берлинской лазури. Малые методы 3:1800220. doi: 10.1002/smtd.201800220
Полнотекстовая перекрестная ссылка | Академия Google
Накаяма Ю. , Сенда Ю., Кавасаки Х., Кошитани Н., Хосой С., Кудо Ю. и др. (2015). Электролиты на основе сульфонов для алюминиевых аккумуляторных батарей. Физ. хим. хим. физ. 17, 5758–5766. дои: 10.1039/c4cp02183e
, Сенда Ю., Кавасаки Х., Кошитани Н., Хосой С., Кудо Ю. и др. (2015). Электролиты на основе сульфонов для алюминиевых аккумуляторных батарей. Физ. хим. хим. физ. 17, 5758–5766. дои: 10.1039/c4cp02183e
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Pan, W.D., Wang, Y.F., Zhang, Y.G., Kwok, H.Y.H., Wu, M.Y., Zhao, X.L., et al. (2019). Недорогая перезаряжаемая алюминий-ионная батарея без дендритов с превосходными характеристиками. Дж. Матер.хим. А 7, 17420–17425. дои: 10.1039/c9ta05207k
Полнотекстовая перекрестная ссылка | Академия Google
Пэн Н., Чжао Н., Чжан З. Г., Ван Х., Лин Х., Лю М. и др. (2017). Стабилизация интерфейса Li/электролит трансплантируемым защитным слоем на основе наноразмерных доменов LiF. Nano Energy 39, 662–672. doi: 10.1016/j.nanoen.2017.07.052
Полнотекстовая перекрестная ссылка | Академия Google
Расул С., Судзуки С., Ямагучи С. и Мияяма М.(2012). Положительные электроды большой емкости для вторичных Mg-ion аккумуляторов. Электрохим. Acta 82, 243–249. doi: 10.1016/j.electacta.2012.03.095
Электрохим. Acta 82, 243–249. doi: 10.1016/j.electacta.2012.03.095
Полнотекстовая перекрестная ссылка | Академия Google
Ребер, Д., Кюнель, Р. С., и Батталья, К. (2019). Подавление кристаллизации водно-солевых электролитов асимметричными анионами делает возможным низкотемпературную работу высоковольтных водных аккумуляторов. Письмо с материалами ACS. 1, 44–51. doi: 10.1021/acsmaterialslett.9b00043
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Радд, Э.Дж., и Гиббонс, Д.В. (1994). Алюминий/кислород с высокой плотностью энергии. J. Источники питания 47, 329–340. дои: 10.1016/0378-7753(94)87012-8
Полнотекстовая перекрестная ссылка | Академия Google
Шин, Дж., Чой, Д.С., Ли, Х.Дж., Юнг, Ю.С., и Чой, Дж.В. (2019). Гидратированная интеркаляция для высокоэффективных водных цинк-ионных аккумуляторов. Доп. Энергия Матер. 9:1
3. doi: 10.1002/aenm.201
3 Полнотекстовая перекрестная ссылка | Академия Google
Сонг, Дж. , Нокед М., Джиллетт Э., Дуэй Дж., Рублофф Г. и Ли С. Б. (2015). Активация катода MnO 2 водным введением Mg 2+ для ионно-магниевого аккумулятора. Физ. хим. хим. физ. 17, 5256–5264. дои: 10.1039/c4cp05591h
, Нокед М., Джиллетт Э., Дуэй Дж., Рублофф Г. и Ли С. Б. (2015). Активация катода MnO 2 водным введением Mg 2+ для ионно-магниевого аккумулятора. Физ. хим. хим. физ. 17, 5256–5264. дои: 10.1039/c4cp05591h
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сонг, М., Тан, Х., Чао, Д.Л., и Фан, Х.Дж. (2018). Последние достижения в области Zn-ионных аккумуляторов. Доп. Веселье. Матер. 28:1802564. doi: 10.1002/adfm.201802564
Полнотекстовая перекрестная ссылка | Академия Google
Су, Д. В., Макдонанг, А., Цяо, С.-, З. и Ван, Г. Х. (2016). Водные калий-ионные батареи большой емкости для крупномасштабного хранения энергии. Доп. Матер. 29:1604007. doi: 10.1002/adma.201604007
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сан, X. К., Даффорт, В., Мехди, Б. Л., Браунинг, Н. Д., и Назар, Л. Ф. (2016). Исследование механизма внедрения Mg в бирнессит в неводных и водных перезаряжаемых Mg-ионных батареях. Хим. Матер. 28, 534–542. doi: 10.1021/acs.chemmater.5b03983
Хим. Матер. 28, 534–542. doi: 10.1021/acs.chemmater.5b03983
Полнотекстовая перекрестная ссылка | Академия Google
Суо, Л.М., Бородин, О., Гао, Т., Ольгин, М., Хо, Дж., Фан, С.Л., и соавт. (2015). Электролит «вода-в-соли» позволяет проводить высоковольтные водные литий-ионные химические процессы. Наука 350, 938–943. doi: 10.1126/science.aab1595
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Суо Л.М., Бородин О., Сунь В., Фан С.Л., Ян С.Ю., Ван Ф. и соавт. (2016). Усовершенствованный высоковольтный литий-ионный аккумулятор на водной основе с электролитом «вода-в-бисоле». Анжю. хим. Междунар. Эд. 55, 7136–7141. doi: 10.1002/ange.201602397
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Суо Л.М., Бородин О., Ван Ю.С., Ронг Х.Х., Сунь В., Фань С.Л. и др. (2017). Электролит «вода-в-соли» делает водную натрий-ионную батарею безопасной, экологичной и долговечной. Доп. Энергия Матер. 7:1701189.doi: 10.1002/aenm.201701189
Энергия Матер. 7:1701189.doi: 10.1002/aenm.201701189
Полнотекстовая перекрестная ссылка | Академия Google
Суо, Л. М., Ху, Ю. С., Ли, Х., Арманд, М., и Чен, Л. К. (2013). Новый класс электролитов на основе растворителя в соли для высокоэнергетических перезаряжаемых металлических литиевых батарей. Нац. коммун. 4:1481. doi: 10.1038/ncomms2513
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ватаману Дж. и Бородин О. (2018). Разветвления межфазной структуры вода-в-соли на заряженных электродах для электрохимической стабильности электролита. J. Phys. хим. лат. 8, 4362–4367. doi: 10.1021/acs.jpclett.7b01879
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ван Ф., Бородин О., Гао Т., Фан С. Л., Сунь В., Хань Ф. Д. и др. (2018а). Металлический цинковый анод с высокой степенью обратимости для аккумуляторов на водной основе. Нац. Матер. 17, 543–549. doi: 10.1038/s41563-018-0063-z
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ван Ф. , Фань С. Л., Гао Т., Сунь В., Ма, З.H., Yang, C.Y., et al. (2017). Высоковольтные водные магниево-ионные батареи. АКЦ Цент. науч. 3, 1121–1128. doi: 10.1021/acscentsci.7b00361
, Фань С. Л., Гао Т., Сунь В., Ма, З.H., Yang, C.Y., et al. (2017). Высоковольтные водные магниево-ионные батареи. АКЦ Цент. науч. 3, 1121–1128. doi: 10.1021/acscentsci.7b00361
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Wang, F.X., Yu, F., Wang, X.W., Chang, Z., Fu, L.J., Zhu, Y.S., et al. (2016). Перезаряжаемый ионно-цинковый/алюминиевый аккумулятор на водной основе с хорошими циклическими характеристиками. Приложение ACS Матер. Интерфейсы 8, 9022–9029. doi: 10.1021/acsami.5b06142
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ван, Г., Фу Л., Чжао Н., Ян Л., Ву Ю. и Ву Х. (2007). Водная перезаряжаемая литиевая батарея с хорошими циклическими характеристиками. Анжю. хим. Междунар. Эд. 46, 295–297. doi: 10.1002/anie.200603699
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ван Х., Ван М. и Тан Ю. Б. (2018b). Новый гибридный суперконденсатор с ионами цинка для долговечных и недорогих накопителей энергии. Материал для хранения энергии. 13, 1–7. doi: 10.1016/j.ensm.2017.12.022
Материал для хранения энергии. 13, 1–7. doi: 10.1016/j.ensm.2017.12.022
Полнотекстовая перекрестная ссылка | Академия Google
Wang, P.P., Chen, Z., Wang, H., Ji, Z.Y., Feng, Y.P., Wang, J.Q., et al. (2020). Высокопроизводительная гибкая перезаряжаемая ионно-алюминиевая батарея на водной основе с длительным сроком службы. Материал для хранения энергии. 25, 426–435. doi: 10.1016/j.ensm.2019.09.038
Полнотекстовая перекрестная ссылка | Академия Google
Ван, Ю. Г., Йи, Дж., и Ся, Ю. Г. (2012). Недавний прогресс в водных литий-ионных батареях. Доп. Энергия Матер. 2, 830–840. doi: 10.1002/aenm.201200065
Полнотекстовая перекрестная ссылка | Академия Google
Ван, Ю.С., Лю, Дж., Ли, Б., Цяо, Р.М., Ян, З.З., Сюй, С.Ю., и др. (2015). Ti-замещенный оксид туннельного типа Na 0,44 MnO 2 в качестве отрицательного электрода для водных натрий-ионных аккумуляторов. Нац. коммун. 6. 1–10. doi: 10.1038/ncomms7401
doi: 10.1038/ncomms7401
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Весселс, К.Д., Педдада, С.В., Хаггинс, Р. А., и Куи, Ю. (2011). Электроды с наночастицами из гексацианоферрата никеля для водных натриевых и калий-ионных аккумуляторов. Нано Летт. 11, 5421–5425. дои: 10.1021/nl203193q
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Wu, X.Y., Luo, Y., Sun, M.Y., Qian, J.F., Cao, Y.L., Ai, X.P., et al. (2015). Нанокубы берлинской лазури с низким уровнем дефектов в качестве катодов большой емкости и длительного срока службы для водных натрий-ионных батарей. Nano Energy 13, 117–124.doi: 10.1016/j.nanoen.2015.02.006
Полнотекстовая перекрестная ссылка | Академия Google
Xie, X.S., Liang, S.Q., Gao, J.W., Guo, S., Guo, J.B., Wang, C., et al. (2020). Управление кинетикой переноса ионов и стабильностью интерфейса для высокопроизводительных анодов из цинкового металла. Энергетика Окружающая среда. науч. 13, 503–510. дои: 10.1039/C9EE03545a
науч. 13, 503–510. дои: 10.1039/C9EE03545a
Полнотекстовая перекрестная ссылка | Академия Google
Сюй, С.Дж., Чен, Ю.Ю., Ши, С., Ли, Дж., Канг, Ф.Ю., и Су, Д.С. (2015).Вторичные батареи с многовалентными ионами для хранения энергии. Науч. Реп. 5:14120. дои: 10.1038/srep14120
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ямада Ю., Усуи К., Содеяма К., Ко С., Татеяма Ю. и Ямада А. (2016). Гидратно-расплавные электролиты для аккумуляторов на водной основе с высокой плотностью энергии. Нац. Энергия. 1:16129. doi: 10.1038/nenergy.2016.129
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ян, Дж., Ван Дж., Лю Х., Бакенов З., Госселинк Д. и Чен П. (2012). Перезаряжаемые гибридные водные батареи. Дж. Источники питания 216, 222–226. doi: 10.1016/j.jpowsour.2012.05.063
Полнотекстовая перекрестная ссылка | Академия Google
Ян, К., Чен, Дж., Цзи, X. , Поллард, Т. П., Лу, X. Дж., Сан, С. Дж., и др. (2019а). Водный литий-ионный аккумулятор, созданный за счет химии превращения галогенов и интеркаляции в графит. Природа 569, 245–250. doi: 10.1038/s41586-019-1175-6
, Поллард, Т. П., Лу, X. Дж., Сан, С. Дж., и др. (2019а). Водный литий-ионный аккумулятор, созданный за счет химии превращения галогенов и интеркаляции в графит. Природа 569, 245–250. doi: 10.1038/s41586-019-1175-6
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ян, Х.C., Li, H.C., Li, J., Sun, Z.H., He, K., Cheng, H.-M., et al. (2019б). Аккумуляторная алюминиевая батарея: возможности и проблемы. Анжю. хим. Междунар. Эд. англ. 58, 11978–11996. doi: 10.1002/anie.201814031
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ю, Х. Д., Штеренберг, И., Гофер, Ю., Гершинский, Г., Пур, Н., и Аурбах, Д. (2013). Аккумуляторы Mg: постоянная задача. Энергетика Окружающая среда. науч. 6:2265. дои: 10.1039/c3ee40871j
Полнотекстовая перекрестная ссылка | Академия Google
Чжан С., Холоубек Дж., Ву С.Ю., Данияр А., Чжу Л.Д., Чен С. и соавт. (2018). ZnCl 2 водно-солевой электролит для обратимого металлического цинкового анода. Хим. коммун. 54, 14097–14099. дои: 10.1039/c8cc07730d
Хим. коммун. 54, 14097–14099. дои: 10.1039/c8cc07730d
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чжан, Дж. Ю., Яо, X. Х., Мисра, Р. К., Цай, К., и Чжао, Ю. Л. (2020). Прогресс в электролитах для нелитий-ионных аккумуляторов. Дж. Матер. науч. Технол. 44, 237–257. doi: 10.1016/j.jmst.2020.01.017
Полнотекстовая перекрестная ссылка | Академия Google
Чжан, Л.Ю., Чен, Л., Чжоу, X.Ф., и Лю, З.П. (2014). К высоковольтным металл-ионным батареям на водной основе выше 1,5 В: система цинк/гексацианоферрат цинка. Доп. Энергия Матер. 5:1400930. doi: 10.1002/aenm.201400930
Полнотекстовая перекрестная ссылка | Академия Google
Чжао, Дж. В., Ли, Ю. К., Пэн, С., Донг, С. М., Ма, Дж., Cui, G.L., et al. (2016). Высоковольтная Zn/LiMn 0,8 Fe 0,2 PO 4 аккумуляторная батарея на водной основе благодаря электролиту «вода-в-соли». Электрохим. коммун. 69, 6–10. doi: 10.1016/j.elecom.2016.05.014
doi: 10.1016/j.elecom.2016.05.014
Полнотекстовая перекрестная ссылка | Академия Google
Чжао, К., Захман, М. Дж., Аль Садат, В. И., Чжэн, Дж. К., Куркутис, Л. Ф., и Арчер, Л. (2018). Твердоэлектролитные межфазные переходы для высокоэнергетических водных алюминиевых электрохимических элементов. Науч. Доп. 4:eaau8131. doi: 10.1126/sciadv.aau8131
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чжао, X.Ю., Чжао-Каргер, З.Р., Фихтнер, М., и Шен, X.Д. (2020). Материалы на основе галогенидов и химия для аккумуляторных батарей. Анжю. хим. Междунар. Эд. 59, 5902–5949. doi: 10.1002/anie.2012
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чжэн, К. Ф., Миура, С., Миядзаки, К., Ко, С., Ватанабэ, Э., Okoshi, M., et al. (2019). Расплавы гидратов натрия и калия, содержащие асимметрические имид-анионы, для высоковольтных водных аккумуляторов. Анжю. хим. Междунар. Эд. англ. 58, 14202–14207. doi: 10.1002/anie.201
58, 14202–14207. doi: 10.1002/anie.201
0 Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Zhou, A.X., Jiang, L.W., Yue, J.M., Tong, Y.X., Zhang, Q.Q., Lin, Z.J., et al. (2019). Водно-солевой электролит обеспечивает высокую емкость катода FeFe(CN) 6 для водной алюминий-ионной батареи. Приложение ACS Матер. Интерфейсы. 11, 41356–41362. дои: 10.1021/acsami.9b14149
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Аккумуляторы на водной основе из диоксида цинка и марганца с высокой плотностью энергии и мощности
Синтез и характеристика материалов
Мы выбрали пиролюзит β-MnO 2 в качестве модельного полиморфа, который, как было показано ранее, проявляет чрезвычайно низкую электрохимическую активность 33 и был приготовлен простым гидротермальным способом в этом исследовании (подробно описан в экспериментальной части).Рентгенограммы (XRD, дополнительный рисунок 1a) показывают высокую чистоту образовавшейся тетрагональной фазы (JCPDS № 24-735) с пространственной группой P42/mnm. Сканирующий электронный микроскоп (СЭМ, дополнительный рисунок 1b) образца показывает морфологию наностержней со средней длиной 2 мкм и шириной 100–200 нм. Полиморфы наностержней α-MnO 2 и γ-MnO 2 также были синтезированы гидротермальным методом (дополнительный рисунок 2; дополнительные методы). Коммерческие порошки β-MnO 2 с крупным размером частиц ~ 2 мкм (дополнительный рис.3) использовались для сравнения.
Сканирующий электронный микроскоп (СЭМ, дополнительный рисунок 1b) образца показывает морфологию наностержней со средней длиной 2 мкм и шириной 100–200 нм. Полиморфы наностержней α-MnO 2 и γ-MnO 2 также были синтезированы гидротермальным методом (дополнительный рисунок 2; дополнительные методы). Коммерческие порошки β-MnO 2 с крупным размером частиц ~ 2 мкм (дополнительный рис.3) использовались для сравнения.
Электродный механизм реакции
На рис. 2а показаны циклические вольтамперограммы (ЦВА) β-MnO 2 в водном 3 M Zn(CF 3 SO 3 ) 2 электролите. Острый пик около 1,06 В наблюдается во время первой катодной развертки. В следующих циклах кривые ЦВА хорошо повторяются с двумя катодными пиками, расположенными при 1,35 и 1,17 В, и перекрывающимся анодным пиком при 1,6/1,65 В. Существенная разница профилей ЦВА между начальным и последующими циклами свидетельствует о фазовом переходе.На рисунке 2b показаны типичные гальваностатические профили β-MnO 2 при 0,32 C. Первая кривая разряда представляет собой плоское плато при напряжении около 1,08 В, в то время как второй цикл представляет собой два наклонных плато разряда, что соответствует результатам CV. Примечательно, что начальная разрядная емкость достигает 307 мАч г −1 , что приближается к теоретической емкости 308 мАч г −1 (в пересчете на MnO 2 ) и соответствует 0,5 Zn 2+ на MnO 0 2 . . Эволюция CV-профилей и плато разряда указывает на другой механизм интеркаляции Zn 2+ в электрод MnO 2 36, 43 , как обсуждается ниже.
Первая кривая разряда представляет собой плоское плато при напряжении около 1,08 В, в то время как второй цикл представляет собой два наклонных плато разряда, что соответствует результатам CV. Примечательно, что начальная разрядная емкость достигает 307 мАч г −1 , что приближается к теоретической емкости 308 мАч г −1 (в пересчете на MnO 2 ) и соответствует 0,5 Zn 2+ на MnO 0 2 . . Эволюция CV-профилей и плато разряда указывает на другой механизм интеркаляции Zn 2+ в электрод MnO 2 36, 43 , как обсуждается ниже.
Рис. 2 Электрохимическая и структурная эволюция β-MnO 2 в ячейке Zn-MnO 2 . a Циклические вольтамперограммы β-MnO 2 электрод при скорости развертки 0,1 мВ с −1 от 0,8 до 1,9 В b Типичные кривые заряда/разряда для первых двух циклов при 0,33 C Zn(CF 3 SO 3 ) 2 водный электролит. Точками A–J отмечены состояния, в которых были собраны данные для рентгеноструктурного анализа. c Рентгенограммы β-MnO 2 электрод в выбранных состояниях во время первого и второго циклов
Точками A–J отмечены состояния, в которых были собраны данные для рентгеноструктурного анализа. c Рентгенограммы β-MnO 2 электрод в выбранных состояниях во время первого и второго циклов
Чтобы исследовать структурную эволюцию β-MnO 2 в процессе разряда/заряда, были записаны рентгенограммы ex-situ (рис. 2c) в выбранных состояниях (отмеченные точки на рис. 2b). При первом разряде (A → D) характерные пики β-MnO 2 постепенно ослабевают и возникает новая фаза. Помимо пиков, отнесенных к соли Zn(CF 3 SO 3 ) 2 , появляются новые пики на 6.47, 13.00, 19.58, 26.28 и 32.93°, которые можно отнести к рефлексам от кристаллографических плоскостей (001)–(005) слоистой фазы Zn-бузерита соответственно. Соль электролита осаждается на поверхности как катода MnO 2 , так и цинкового анода, но ее можно легко удалить, погрузив и промыв водой (дополнительный рисунок 4a – c). Примечательно, что XRD-шаблон промывшего катода отличается от ранее сообщенного вида (например, MNOOH 35 , Spinel ZNMN 2 O 4 O 4 39 , Birnessite 38 , туннелированный γ-ZNMNO 2 34 и многослойный L-Zn x MnO 2 34 ) в разряженных электродах MnO 2 (дополнительный рис. 4г). Уточнение Ритвельдом данных РФА разряженного электрода предполагает образование фазы Zn-бузерита (дополнительный рисунок 4e). Точный структурный мотив Zn-бузерита еще не определен, но будет дополнительно изучен в будущем. Фаза Zn-бузерита, обычно встречающаяся в слоистом оксидном минерале Mn 44,45,46 , содержит слои H 2 O в каналах между двумя октоэдрическими плитами MnO 6 (рис. 1b), обладающими аналогичной структурой с Ca-бусерит 44 (JCPDS No.50-0015). Катионы Zn 2+ располагаются над и под вакантными позициями Mn и координируются тремя атомами O, соседними с вакансиями, и тремя атомами O из прослойки H 2 O 36, 44,45,46 . Присутствие H 2 O в выброшенных частицах было подтверждено с помощью термогравиметрического анализа (ТГА), указывающего на состав ~ 2,28 молекулярного H 2 O по формуле Zn-бузерита (дополнительный рисунок 5). В последующем процессе зарядки (D→F) интенсивность характерных пиков для слоистой фазы постепенно ослабевала при извлечении ионов Zn.
4г). Уточнение Ритвельдом данных РФА разряженного электрода предполагает образование фазы Zn-бузерита (дополнительный рисунок 4e). Точный структурный мотив Zn-бузерита еще не определен, но будет дополнительно изучен в будущем. Фаза Zn-бузерита, обычно встречающаяся в слоистом оксидном минерале Mn 44,45,46 , содержит слои H 2 O в каналах между двумя октоэдрическими плитами MnO 6 (рис. 1b), обладающими аналогичной структурой с Ca-бусерит 44 (JCPDS No.50-0015). Катионы Zn 2+ располагаются над и под вакантными позициями Mn и координируются тремя атомами O, соседними с вакансиями, и тремя атомами O из прослойки H 2 O 36, 44,45,46 . Присутствие H 2 O в выброшенных частицах было подтверждено с помощью термогравиметрического анализа (ТГА), указывающего на состав ~ 2,28 молекулярного H 2 O по формуле Zn-бузерита (дополнительный рисунок 5). В последующем процессе зарядки (D→F) интенсивность характерных пиков для слоистой фазы постепенно ослабевала при извлечении ионов Zn. Это пиковое затухание можно объяснить уменьшением концентрации рассеивающих атомов в элементарной ячейке и ослаблением взаимодействия Zn–O из-за выхода Zn. Подобное изменение интенсивности отражения (00 l ) наблюдалось на слоистых интеркаляционных электродах, таких как оксиды ванадия 9, 47 . Во втором цикле сигналы слоистого соединения обратимо усиливались/ослаблялись при введении/экстракции Zn 2+ . Присутствие β-MnO 2 можно наблюдать в первые несколько циклов, но его нельзя различить после 10 циклов (дополнительный рис.6). Мы также исследовали структурную эволюцию катодов α-MnO 2 и γ-MnO 2 . Интересно, что эти два полиморфа претерпевают фазовое превращение в слоистый Zn-бузерит при первом разряде и обратимое внедрение Zn в слоистую структуру при последующем циклировании (дополнительные рисунки 7 и 8), напоминая случай β-MnO 2 . Результаты предполагают общий механизм электродной реакции в туннельных полиморфах MnO 2 , который, насколько нам известно, впервые выяснен в слабокислых электролитах.
Это пиковое затухание можно объяснить уменьшением концентрации рассеивающих атомов в элементарной ячейке и ослаблением взаимодействия Zn–O из-за выхода Zn. Подобное изменение интенсивности отражения (00 l ) наблюдалось на слоистых интеркаляционных электродах, таких как оксиды ванадия 9, 47 . Во втором цикле сигналы слоистого соединения обратимо усиливались/ослаблялись при введении/экстракции Zn 2+ . Присутствие β-MnO 2 можно наблюдать в первые несколько циклов, но его нельзя различить после 10 циклов (дополнительный рис.6). Мы также исследовали структурную эволюцию катодов α-MnO 2 и γ-MnO 2 . Интересно, что эти два полиморфа претерпевают фазовое превращение в слоистый Zn-бузерит при первом разряде и обратимое внедрение Zn в слоистую структуру при последующем циклировании (дополнительные рисунки 7 и 8), напоминая случай β-MnO 2 . Результаты предполагают общий механизм электродной реакции в туннельных полиморфах MnO 2 , который, насколько нам известно, впервые выяснен в слабокислых электролитах.
Структурная эволюция электрода β-MnO 2 была дополнительно исследована с помощью ПЭМ-анализа ex-situ. На рисунке 3a, b показаны изображения ПЭМ и ПЭМ высокого разрешения (HRTEM) в исходном состоянии, где полосы решетки могут быть отнесены к плоскости (110) β-MnO 2 . Кольцевое изображение ПЭМ (ABF-STEM) со сканированием в светлом поле (рис. 3c) ясно показывает расположение атомов в туннельном каркасе, если схематически смотреть вдоль направления [100] решетки (рис.3г). После полной разрядки одномерная форма наностержня сохраняется, а поверхность электрода становится шероховатой с образованием агрегированных наночастиц (рис. 3д), что связывают с искажением структуры в процессе фазового превращения. Наблюдаемые полосы решетки с межплоскостными расстояниями 0,45, 0,64 и 1,29 нм соответствуют плоскостям (003), (002) и (001) Zn-бузерита (рис. 3f и дополнительный рис. 9a) соответственно, что согласуется с рентгеноструктурный анализ.
Рис. 3
3 Анализ микроструктуры и состава MnO 2 . a изображение TEM, b изображение HRTEM, c изображение ABF-STEM и d схематическая модель атома (если смотреть со стороны оси зоны [100]) в исходном состоянии. e TEM-изображение, f HRTEM-изображение, g профили линейного сканирования EDS в TEM и h XPS-спектры первого полностью разряженного электрода. Масштабные линейки , 50 нм a , e ; 5 нм б , ж ; и 1 нм c соответственно
Для устранения влияния осажденной соли электролита разряженный электрод промывали водой для элементно-дисперсионной спектроскопии (ЭДС) и рентгенофотоэлектронной спектроскопии (РФЭС).Профиль линейного сканирования в ПЭМ (рис. 3g) и картирование элементов (дополнительный рис. 9b) в STEM разряженного электрода показывают равномерное распределение Zn, Mn и O, тогда как S и F из электролита не обнаруживаются (рис. 3g). ). В спектрах XPS энергетическое расщепление (Δ E ) пиков дублетов Mn 3 s составляет 4,7 и 5,0 эВ для исходных и разряженных электродов соответственно, что указывает на пониженную валентность Mn после введения Zn (рис. 3h). В разряженном состоянии появляется новый пик Zn 3p при 92.0 эВ, что ниже, чем у Zn(CF 3 SO 3 ) 2 (92,7 эВ), и может быть отнесено к интеркалированному Zn. Эти результаты подтверждают присутствие ионов Zn 2+ в структуре слоистого оксида марганца и исключают возможность электродных реакций, связанных с анионами CF 3 SO 3 − . Кроме того, ПЭМ-изображения электрода β-MnO 2 после различных циклов (дополнительный рисунок 10) указывают на расширение и расслоение наностержней, что связано с фазовым переходом, растворением Mn и повторным интеркалированием Zn 2+ , и будет несут потери мощности во время циклирования.
3g). ). В спектрах XPS энергетическое расщепление (Δ E ) пиков дублетов Mn 3 s составляет 4,7 и 5,0 эВ для исходных и разряженных электродов соответственно, что указывает на пониженную валентность Mn после введения Zn (рис. 3h). В разряженном состоянии появляется новый пик Zn 3p при 92.0 эВ, что ниже, чем у Zn(CF 3 SO 3 ) 2 (92,7 эВ), и может быть отнесено к интеркалированному Zn. Эти результаты подтверждают присутствие ионов Zn 2+ в структуре слоистого оксида марганца и исключают возможность электродных реакций, связанных с анионами CF 3 SO 3 − . Кроме того, ПЭМ-изображения электрода β-MnO 2 после различных циклов (дополнительный рисунок 10) указывают на расширение и расслоение наностержней, что связано с фазовым переходом, растворением Mn и повторным интеркалированием Zn 2+ , и будет несут потери мощности во время циклирования.
Чтобы получить представление об изменении степени окисления Mn и электронной структуры в процессе (де)интеркаляции, мы выполнили синхротронную XAS характеристику, которая продемонстрировала свою полезность для анализа оксидов марганца 48,49,50,51,52 . На рисунке 4a показаны нормализованные профили Mn K-края XANES (рентгеновская структура поглощения вблизи края) электрода β-MnO 2 в выбранных состояниях в первых двух циклах. Номинальная валентность Mn была построена в зависимости от энергии возбуждения эталонных оксидов марганца, чтобы установить линейную корреляцию (рис.4б). При разрядке весь край смещается в сторону более низкой энергии, что указывает на уменьшение средней степени окисления Mn. Средняя валентность Mn в полностью разряженном состоянии оценивается в 3,6. При первой зарядке положение края немного смещается обратно в сторону более высоких энергий, а во втором цикле остается практически неизменным. Интересно, что валентность Mn должна увеличиваться/уменьшаться при интеркаляции/деинтеркаляции Zn 2+ и приближаться к 3 для полностью разряженного электрода, как и ожидалось по разряженной емкости (рис.2б). Мы постулируем, что такое неожиданное наблюдение может быть приписано к непропорциональному растворению трехвалентных видов Mn (Mn 3+ S → MN 4+ S + MN 2+ AQ ) 38, 53 .
На рисунке 4a показаны нормализованные профили Mn K-края XANES (рентгеновская структура поглощения вблизи края) электрода β-MnO 2 в выбранных состояниях в первых двух циклах. Номинальная валентность Mn была построена в зависимости от энергии возбуждения эталонных оксидов марганца, чтобы установить линейную корреляцию (рис.4б). При разрядке весь край смещается в сторону более низкой энергии, что указывает на уменьшение средней степени окисления Mn. Средняя валентность Mn в полностью разряженном состоянии оценивается в 3,6. При первой зарядке положение края немного смещается обратно в сторону более высоких энергий, а во втором цикле остается практически неизменным. Интересно, что валентность Mn должна увеличиваться/уменьшаться при интеркаляции/деинтеркаляции Zn 2+ и приближаться к 3 для полностью разряженного электрода, как и ожидалось по разряженной емкости (рис.2б). Мы постулируем, что такое неожиданное наблюдение может быть приписано к непропорциональному растворению трехвалентных видов Mn (Mn 3+ S → MN 4+ S + MN 2+ AQ ) 38, 53 . Анализ Mn с помощью атомно-эмиссионного спектрометра с индуктивно связанной плазмой (ICP-AES) свидетельствует об изменении концентрации Mn в электролите (дополнительный рисунок 11; дополнительное примечание 1). При разрядке количество растворенного Mn увеличивается и соответствует ~ 8.9% от общего марганца при полном разряде. Частичное растворение Mn в электролите является возможным объяснением заметной потери емкости при циклировании.
Анализ Mn с помощью атомно-эмиссионного спектрометра с индуктивно связанной плазмой (ICP-AES) свидетельствует об изменении концентрации Mn в электролите (дополнительный рисунок 11; дополнительное примечание 1). При разрядке количество растворенного Mn увеличивается и соответствует ~ 8.9% от общего марганца при полном разряде. Частичное растворение Mn в электролите является возможным объяснением заметной потери емкости при циклировании.
Рис. 4 XAS-характеристика β-MnO 2 электрод. a Mn-K edge Кривые XANES при выбранных состояниях разряда/заряда по отношению к стандартным MnO, Mn 2 O 3, и Mn 3 O 4 . b Установленная линейная зависимость между энергией фотона и степенью окисления элемента Mn. c Спектры EXAFS. d Схематическое изображение элементарной ячейки β-MnO 2
На рисунке 4c показаны спектры EXAFS (тонкая структура с расширенным рентгеновским поглощением) электрода β-MnO 2 на выбранных стадиях (де)интеркаляции цинка. Самый сильный пик, расположенный при 1,5 Å, относится к ближайшему кислороду (Mn-O) в октаэдрах MnO 6 . Пики при 2,5 и 3,0 Å относятся к Mn в октаэдрах с общими ребрами (Mn-Mn ребро ) и общими углами (Mn-Mn угол ) MnO 6 октаэдров (рис.4г), соответственно 51, 54 . Когда электрод был полностью разряжен, относительная интенсивность пика Mn-Mn угла уменьшилась в гораздо большей степени, чем у сигналов Mn-O и Mn-Mn края (дополнительный рисунок 12). Этот результат указывает на разрыв октаэдров MnO 6 с общими углами. Кроме того, пик 3,0 Å уширяется и немного смещается на большее расстояние, что связано с образованием энергопоглощающего пути Mn-O-Zn между слоистыми пластинами октоэдра MnO 6 и внедренными ионами Zn.Сравнение кристаллографической структуры β-MnO 2 и Zn-бузерита позволяет предположить, что совместное внедрение Zn 2+ и H 2 O и растворение Mn искажают каркас пиролюзита, оставляя вакансии Mn в верхние/нижележащие слои и образование слоистого Zn-бузерита.
Самый сильный пик, расположенный при 1,5 Å, относится к ближайшему кислороду (Mn-O) в октаэдрах MnO 6 . Пики при 2,5 и 3,0 Å относятся к Mn в октаэдрах с общими ребрами (Mn-Mn ребро ) и общими углами (Mn-Mn угол ) MnO 6 октаэдров (рис.4г), соответственно 51, 54 . Когда электрод был полностью разряжен, относительная интенсивность пика Mn-Mn угла уменьшилась в гораздо большей степени, чем у сигналов Mn-O и Mn-Mn края (дополнительный рисунок 12). Этот результат указывает на разрыв октаэдров MnO 6 с общими углами. Кроме того, пик 3,0 Å уширяется и немного смещается на большее расстояние, что связано с образованием энергопоглощающего пути Mn-O-Zn между слоистыми пластинами октоэдра MnO 6 и внедренными ионами Zn.Сравнение кристаллографической структуры β-MnO 2 и Zn-бузерита позволяет предположить, что совместное внедрение Zn 2+ и H 2 O и растворение Mn искажают каркас пиролюзита, оставляя вакансии Mn в верхние/нижележащие слои и образование слоистого Zn-бузерита. Этот фазовый переход из туннеля в слой является необратимым, на что указывает отсутствие восстановления спектров EXAFS при первой перезарядке. При этом уширенный пик 3,0 Å не полностью восстанавливается после второй зарядки, что можно объяснить потерей емкости (рис.2б). Примечательно, что XAS-анализ электродов α-MnO 2 и γ-MnO 2 (дополнительный рисунок 13) показывает сходное поведение с поведением β-MnO 2 , что снова указывает на общий механизм электродной реакции среди различных туннелированных MnO 2 полиморфов.
Этот фазовый переход из туннеля в слой является необратимым, на что указывает отсутствие восстановления спектров EXAFS при первой перезарядке. При этом уширенный пик 3,0 Å не полностью восстанавливается после второй зарядки, что можно объяснить потерей емкости (рис.2б). Примечательно, что XAS-анализ электродов α-MnO 2 и γ-MnO 2 (дополнительный рисунок 13) показывает сходное поведение с поведением β-MnO 2 , что снова указывает на общий механизм электродной реакции среди различных туннелированных MnO 2 полиморфов.
Электрохимические характеристики
Для оценки электрохимических характеристик ячейка монетного типа Zn-MnO 2 была собрана в окружающем воздухе с использованием наностержневого катода β-MnO 2 , анода из цинковой фольги, сепаратора из фильтровальной бумаги и водного Zn( CF 3 SO 3 ) 2 электролит.Концентрированный 3 M Zn(CF 3 SO 3 ) 2 обеспечивает лучшую циклическую стабильность, чем разбавленный электролит (например, 1 M) (дополнительный рисунок 14), что объясняется снижением активности воды и воды. индуцированные побочные реакции 4, 24, 55 . Как показано на рис. 1в, ячейки на основе мягкокислого электролита (3 M ZnSO 4 , pH ~ 3,4; 3 M Zn(CF 3 SO 3 ) 2 , pH ~ 3,6) показывают гораздо лучшие результаты. производительность при циклировании по сравнению с использованием электролита КОН.Между тем, элемент с использованием электролита Zn(CF 3 SO 3 ) 2 обеспечивает значительно более высокую начальную разрядную емкость, чем у ZnSO 4 (275 против 120 мАч г −1 ) при 0,65 C. аналогичное ухудшение емкости наблюдается при циклировании из-за потери активной массы. Чтобы решить эту проблему, мы предварительно добавили соли Mn 2+ в электролит, чтобы обеспечить равновесие растворения Mn 2+ из электрода MnO 2 . Путем устранения анионного эффекта в качестве добавки к электролиту был выбран Mn(CF 3 SO 3 ) 2 с концентрацией от разбавленного 0.
индуцированные побочные реакции 4, 24, 55 . Как показано на рис. 1в, ячейки на основе мягкокислого электролита (3 M ZnSO 4 , pH ~ 3,4; 3 M Zn(CF 3 SO 3 ) 2 , pH ~ 3,6) показывают гораздо лучшие результаты. производительность при циклировании по сравнению с использованием электролита КОН.Между тем, элемент с использованием электролита Zn(CF 3 SO 3 ) 2 обеспечивает значительно более высокую начальную разрядную емкость, чем у ZnSO 4 (275 против 120 мАч г −1 ) при 0,65 C. аналогичное ухудшение емкости наблюдается при циклировании из-за потери активной массы. Чтобы решить эту проблему, мы предварительно добавили соли Mn 2+ в электролит, чтобы обеспечить равновесие растворения Mn 2+ из электрода MnO 2 . Путем устранения анионного эффекта в качестве добавки к электролиту был выбран Mn(CF 3 SO 3 ) 2 с концентрацией от разбавленного 0. 01 м до насыщенного 0,1 М. Оптимизированная композиция электролита была найдена 3 м Zn (CF 3 SO 3 ) 2 + 0,1 м МН (CF 3 SO 3 ) 2 , что приводит к наивысшей кулоновской эффективности и ионной проводимости, а также к высокой емкости 225 мАч г -1 после 100 циклов (дополнительные рисунки 15 и 16).
01 м до насыщенного 0,1 М. Оптимизированная композиция электролита была найдена 3 м Zn (CF 3 SO 3 ) 2 + 0,1 м МН (CF 3 SO 3 ) 2 , что приводит к наивысшей кулоновской эффективности и ионной проводимости, а также к высокой емкости 225 мАч г -1 после 100 циклов (дополнительные рисунки 15 и 16).
На рисунке 5а показаны профили заряда/разряда элементов Zn-MnO 2 при различных плотностях тока.Разрядные емкости 258, 213, 188, 151 и 115 мАч г·–1· были зарегистрированы при скоростях 0,65, 1,62, 3,25, 6,50 и 16,20 C соответственно. Даже при высокой температуре 32,5°С можно было получить обратимую емкость 100 мАч г -1 . Кроме того, когда скорость вернулась к 0,65°C, емкость восстановилась до 246 мАч г -1 , демонстрируя сильную толерантность к быстрому введению / извлечению ионов Zn 2+ (дополнительный рисунок 17). Превосходные показатели производительности можно дополнительно увидеть на графиках Рагона (удельная энергия по сравнению с энергопотреблением). Специфическая мощность), сравнивая систему Zn-Mno 2 для зарегистрированных α-mno 2 3 , Δ-mno 2 56 , Zn 0.25 V 2 O 5 · NH 2 O 9 O 9 O 9 O 9 , ZN 1,86 мн 2 O 4 24 , Todorokite 37 , KCUFE (CN) 6 (CUHCF) 21 и ZN 3 [ CN) 6 ] 2 (ZnHCF) 57 катоды для водных ZIB (рис.5б). Высокая удельная энергия и удельная мощность (254 Втч кг −1 при 197 Вт кг −1 ; 110 Втч кг −1 при 5910 Вт кг −1 ) могут быть достигнуты одновременно для перспективной энергетики, что является приложения для хранения. Ячейку Zn-MnO 2 гальваностатически разряжали/заряжали при 6,50 C (рис. 5c) для оценки стабильности при длительном циклировании. Примечательно, что обратимая емкость поддерживает 135 мАч g −1 с сохранением емкости 94% в течение 2000 циклов и кулоновской эффективностью, приближающейся к 100%.
Специфическая мощность), сравнивая систему Zn-Mno 2 для зарегистрированных α-mno 2 3 , Δ-mno 2 56 , Zn 0.25 V 2 O 5 · NH 2 O 9 O 9 O 9 O 9 , ZN 1,86 мн 2 O 4 24 , Todorokite 37 , KCUFE (CN) 6 (CUHCF) 21 и ZN 3 [ CN) 6 ] 2 (ZnHCF) 57 катоды для водных ZIB (рис.5б). Высокая удельная энергия и удельная мощность (254 Втч кг −1 при 197 Вт кг −1 ; 110 Втч кг −1 при 5910 Вт кг −1 ) могут быть достигнуты одновременно для перспективной энергетики, что является приложения для хранения. Ячейку Zn-MnO 2 гальваностатически разряжали/заряжали при 6,50 C (рис. 5c) для оценки стабильности при длительном циклировании. Примечательно, что обратимая емкость поддерживает 135 мАч g −1 с сохранением емкости 94% в течение 2000 циклов и кулоновской эффективностью, приближающейся к 100%.
Рис. 5 Электрохимические показатели Zn-Mno 2 клетки в 3 м Zn (CF 3 SO 3 ) 2 Электролит с 0,1 м МН (CF 3 SO 3 ) 2 добавка. a Профили разряда/заряда при различных скоростях C. b Графики Ragone для батареи Zn-MnO 2 и ZIB с другими заявленными катодными материалами. Значения основаны на общей активной массе катода и анода. c Долговечность при норме 6.5 C. Врезка показывает изменение емкости на первых 19 циклах
Мы также исследовали клетки ZN-MNO 2 с 3 м ZnSO 4 + 0,1 м MNSO 4 и 3 м Zn (CF 3 SO 3 ) 2 + 0,1 м МНСО 4 электролиты, которые обеспечивали начальную разрядную емкость 110 и 205 мАч г -1 соответственно (дополнительный рисунок 18). В электролите на основе SO 4 2− увеличение емкости наблюдалось в течение первых нескольких циклов, что было связано с процессом активации, аналогичным образом обнаруженным в описанных катодах α-/γ-MnO 2 34,35,36 . Интересно, что электролит на основе CF 3 SO 3 − обладает гораздо более высокой начальной разрядной емкостью (275 мАч г −1 при 0,65 C) и приводит к стабилизации емкости после ~ 10 циклов. Различное поведение можно приписать раствору Zn (CF 3 SO 3 ) 2 , который не только обладает более высокой ионной проводимостью (дополнительный рисунок 19), но также обеспечивает более быструю кинетику и более высокую стабильность цинкового покрытия / снятия, поскольку по сравнению с сульфатными и щелочными электролитами (дополнительный рис.20; Дополнительное примечание 2). Кроме того, объемный анион CF 3 SO 3 − (по сравнению с SO 4 2− с двойным зарядом) может уменьшить количество молекул воды, окружающих катионы Zn 2+ , и уменьшить эффект сольватации. 24 , что облегчает транспорт ионов Zn 2+ и перенос заряда.
Интересно, что электролит на основе CF 3 SO 3 − обладает гораздо более высокой начальной разрядной емкостью (275 мАч г −1 при 0,65 C) и приводит к стабилизации емкости после ~ 10 циклов. Различное поведение можно приписать раствору Zn (CF 3 SO 3 ) 2 , который не только обладает более высокой ионной проводимостью (дополнительный рисунок 19), но также обеспечивает более быструю кинетику и более высокую стабильность цинкового покрытия / снятия, поскольку по сравнению с сульфатными и щелочными электролитами (дополнительный рис.20; Дополнительное примечание 2). Кроме того, объемный анион CF 3 SO 3 − (по сравнению с SO 4 2− с двойным зарядом) может уменьшить количество молекул воды, окружающих катионы Zn 2+ , и уменьшить эффект сольватации. 24 , что облегчает транспорт ионов Zn 2+ и перенос заряда.
Хотя было продемонстрировано, что предварительное добавление Mn 2+ в электролит улучшает циклируемость MnO 2 электрода 35 , основной механизм остается неясным. {\rm{\theta}}} = 2.{2 + }}/{\rm{Zn}}} \right)$$
{\rm{\theta}}} = 2.{2 + }}/{\rm{Zn}}} \right)$$
(2)
Согласно уравнению Нернста, требуемые теоретические потенциалы для образования MnO 2 и Mn 2 O 3 в Mn(CF 3 SO 3 ) 2 (pH 0,1 0M) равны 1,6 M 3 и 1,26 В (относительно Zn 2+ /Zn) соответственно; соответствующие значения составляют 1,60 и 1,64 В в 3 M Zn(CF 3 SO 3 ) 2 электролите, содержащем 0.1 M Mn 2+ (рН 3,8). Эта оценка согласуется с результатами вольтамперометрии трехэлектродных измерений (дополнительный рисунок 21; дополнительное примечание 3), которые также показывают, что Mn 2+ не восстанавливается в пределах исследованных окон потенциала. После зарядки в 3 M Zn(CF 3 SO 3 ) 2 + 0,1 M Mn(CF 3 SO 3 ) 2 на электроде электролита наблюдается коричневый слой нагара. Слой состоит из оксида марганца со степенью окисления Mn от + 3 до + 4 и имеет морфологию нанолистов и плохую кристалличность, как было проанализировано с помощью SEM, XRD, Raman, XPS и XAENS (дополнительный рис.22).
Слой состоит из оксида марганца со степенью окисления Mn от + 3 до + 4 и имеет морфологию нанолистов и плохую кристалличность, как было проанализировано с помощью SEM, XRD, Raman, XPS и XAENS (дополнительный рис.22).
в постпортированном анализе ячейки Zn-Mno 2 с использованием 3 м Zn (CF 3 SO 3 ) 2 + 0,1 м МН (CF 3 SO 3 ) 2 Электролит , мы также наблюдали взаимосвязанный пористый MnO x на поверхности катода после зарядки (рис. 6а, б). СЭМ-изображение поперечного сечения и изображения элементного картирования (рис. 6с) свидетельствуют о наличии однородного слоя толщиной около 10 мкм.ПЭМ-визуализация и анализ электронной дифракции на выбранных участках (SAED) показывают микроструктуру пористого нанолиста и аморфный характер осажденного слоя (рис. 6d), что может способствовать массовой диффузии. Напротив, в 3 M Zn(CF 3 SO 3 ) 2 электроде без Mn(CF 3 SO 3 ) целостность электрода β-MnO 2 была серьезно нарушена с образованием трещин. ) 2 добавка (рис. 6e). Распыление электрода может нарушить электронную проводящую сеть и увеличить поляризацию электрода, что еще больше усугубит снижение емкости.Спектроскопию электрохимического импеданса (ЭИС) проводили в трехэлектродной ячейке, используя демонтированный после десяти циклов катод в качестве рабочего электрода, платиновую пластину в качестве противоэлектрода и насыщенный каломельный электрод (НКЭ) в качестве электрода сравнения. Циклический электрод в электролите с добавлением Mn 2+ имеет два вдавленных полукруга в области высоких частот и одну линию в области низких частот (рис. 6f). Подгонка данных EIS (дополнительная таблица 1) дает последовательное сопротивление ( R с , 4.5 Ом), сопротивление интерфейса ( Ом i , 6,0 Ом) между электролитом и наплавленным слоем, сопротивление переносу заряда ( R ct , 25 Ω) и импеданс диффузии Варбурга ( Z Вт , 124,7 Ом). Для сравнения, элемент без добавки электролита показывает более высокое значение R . с (8,0 Ом), R ct (350 Ом) и Z Вт (1200 Ом), при отсутствии видимой интерфейсной составляющей (рис.6г).
) 2 добавка (рис. 6e). Распыление электрода может нарушить электронную проводящую сеть и увеличить поляризацию электрода, что еще больше усугубит снижение емкости.Спектроскопию электрохимического импеданса (ЭИС) проводили в трехэлектродной ячейке, используя демонтированный после десяти циклов катод в качестве рабочего электрода, платиновую пластину в качестве противоэлектрода и насыщенный каломельный электрод (НКЭ) в качестве электрода сравнения. Циклический электрод в электролите с добавлением Mn 2+ имеет два вдавленных полукруга в области высоких частот и одну линию в области низких частот (рис. 6f). Подгонка данных EIS (дополнительная таблица 1) дает последовательное сопротивление ( R с , 4.5 Ом), сопротивление интерфейса ( Ом i , 6,0 Ом) между электролитом и наплавленным слоем, сопротивление переносу заряда ( R ct , 25 Ω) и импеданс диффузии Варбурга ( Z Вт , 124,7 Ом). Для сравнения, элемент без добавки электролита показывает более высокое значение R . с (8,0 Ом), R ct (350 Ом) и Z Вт (1200 Ом), при отсутствии видимой интерфейсной составляющей (рис.6г).
Рис. 6 Функция предварительно добавленного Mn 2+ в электролит. a , b , c , e СЭМ, d ПЭМ-изображения и f , g трехэлектродная ячейка EIS повторно полученного цикла tenM с катодами Zn3 (CF 3 SO 3 ) 2 Electrolyte A — D , F , E , г , G без 0,1 м мн (CF 3 SO 3 ) 2 добавка . Врезки из c , d показывают элементное картирование и шаблон SAED соответственно. На вставках из f , g показана эквивалентная схема для соответствия данным EIS, где R с , Р и , Р карат , CPE и Z w представляют собой последовательное сопротивление, сопротивление поверхности раздела между электролитом и осажденным слоем, сопротивление переноса заряда, элемент с постоянной фазой и процесс диффузии Варбурга соответственно. Масштабные линейки , 5 мкм a , e ; 1 мкм б ; 10 мкм в ; 100 нм д ; и 5 1/нм ( вставка из d ), соответственно
Основываясь на вышеприведенных результатах, мы предлагаем три преимущества добавки к электролиту Mn 2+ для батареи Zn-MnO 2 : (1) размещение и компенсация растворения Mn 2+ с электрода, (2) улучшение начальная кулоновская эффективность и ионная проводимость электролита и (3) образование однородного пористого наноструктурированного MnO x на поверхности катода, что помогает поддерживать целостность электрода и способствует переносу заряда.Обратите внимание, что сгенерированный MnO x Сам слой обеспечивает почти 2,4% емкости, обеспечиваемой активным материалом (дополнительный рисунок 23). Электролит Zn(CF 3 SO 3 ) 2 + Mn(CF 3 SO 3 ) 2 также применим для улучшения циклической стабильности наноструктурированного 90 α-190 90 MnO. Катоды MnO 2 (дополнительный рисунок 24a, b). Кроме того, коммерческие порошки β-MnO 2 с неправильной формой и микрометровым размером частиц (дополнительный рис.3) также демонстрируют значительную емкость (132 мАч г -1 при 0,65 C) и циклируемость (200 циклов) в этом электролите (дополнительный рисунок 24c, d).
Zn-анод также был исследован, чтобы понять высокоэффективный химический состав ячейки Zn-MnO 2 (дополнительные рисунки 25–28). Посмертный анализ циклированного Zn в трехэлектродной ячейке с 3 M Zn(CF 3 SO 3 ) 2 + 0,1 M Mn(CF 3 SO 3 ) 2
2
и морфология поверхности без дендритов после 280 часов многократного цинкования/зачистки (дополнительный рис.25). В полной ячейке Zn-MnO 2 после теста скорости не было обнаружено ни дендритной морфологии, ни образования побочных продуктов, таких как ZnO или Zn(OH) 2 (дополнительный рисунок 26), что свидетельствует в пользу циклической стабильности Zn-MnO 2 батареи . Напротив, в электролите 3 M ZnSO 4 + 0,1 M MnSO 4 пластина Zn с множеством трещин образовалась на поверхности цинка, в то время как наностержни ZnO наблюдались в электролите KOH, что могло бы ограничить циклируемость Zn (дополнительные рисунки). .25 и 27). Кроме того, анализ EDS показывает, что в цинковом аноде нет обнаруживаемого Mn (дополнительный рисунок 28). Батарея будущего? Инновационная химия батареи произвела революцию в воздушно-цинковой батарее
Основой инновационной химии для воздушно-цинковых батарей является нещелочной водный электролит. Кредит: WWU — MEET (Джудит Крафт)
Международное сотрудничество в области исследований экологически безопасных аккумуляторов будущего
Высокопроизводительные, экологичные, безопасные и в то же время экономичные: воздушно-цинковые батареи представляют собой привлекательную технологию хранения энергии будущего.
До сих пор обычная воздушно-цинковая батарея боролась с высокой химической нестабильностью, паразитные реакции, коренящиеся в использовании щелочных электролитов, приводили к электрохимической необратимости. На основе инновационного нещелочного электролита на водной основе международная исследовательская группа под руководством ученого доктора Вэй Суна из Исследовательского центра аккумуляторов MEET при Университете Мюнстера разработала новый химический состав для воздушно-цинковых аккумуляторов, который превосходит предыдущие технические характеристики. препятствия.
Научная группа опубликовала подробные результаты своего исследовательского проекта с участием исследователей из Университета Фудань в Шанхае, Университета науки и технологии в Ухане, Университета Мэриленда и Исследовательской лаборатории армии США в журнале Science .
Основные параметры воздушно-цинковой батареи оптимизированы
«Наш инновационный нещелочной электролит привносит ранее неизвестную обратимую химию перекиси цинка (ZnO2)/O2 в воздушно-цинковую батарею», — объясняет доктор.Вэй Сун. По сравнению с традиционными сильными щелочными электролитами недавно разработанный нещелочной водный электролит на основе соли трифторметансульфоната цинка имеет несколько решающих преимуществ: цинковый анод используется более эффективно с более высокой химической стабильностью и электрохимической обратимостью. Сконструированные таким образом полные цинково-воздушные батареи могут длительно стабильно работать в течение 320 циклов и 1600 часов в атмосфере окружающего воздуха.
Механизм химического состава этой батареи ZnO2/O2 и роль гидрофобного аниона трифторметансульфоната были систематически выявлены с использованием хорошо разработанных электрохимических, аналитических методов и многомасштабного моделирования.Выявленная повышенная плотность энергии теперь может составить конкуренцию литий-ионным батареям, доминирующим в настоящее время на рынке.
«Воздушно-цинковые батареи представляют собой потенциальную альтернативную аккумуляторную технологию с такими преимуществами, как экологичность, высокая безопасность и низкая стоимость», — подчеркивает Сан. «Эта технология все еще требует дальнейших интенсивных исследований и оптимизации перед ее практическим применением».
Ссылка: «Перезаряжаемая воздушно-цинковая батарея на основе химии пероксида цинка», авторы Вей Сунь, Фей Ван, Бао Чжан, Менги Чжан, Верена Кюперс, Сяо Цзи, Клаудия Тейле, Питер Бикер, Кан Сюй, Чуншэн Ван и Мартин Винтер, 1 января 2021 г., Наука .
DOI: 10.1126/science.abb9554
Растущие экологические издержки нашего пристрастия к литиевым батареям
В Южной Америке самой большой проблемой является вода. Литиевый треугольник континента, который охватывает части Аргентины, Боливии и Чили, содержит более половины мировых запасов металла под своими потусторонними солончаками. Это также одно из самых засушливых мест на земле. Это реальная проблема, потому что для извлечения лития горняки начинают с бурения скважины в солончаках и закачки соленой, богатой минералами соляной воды на поверхность.
Затем они оставляют его испаряться на месяцы, сначала создавая смесь солей марганца, калия, буры и лития, которую затем фильтруют и помещают в другой испарительный бассейн, и так далее. Через 12–18 месяцев смесь достаточно фильтруется, чтобы можно было извлечь карбонат лития — белое золото.
Это относительно дешевый и эффективный процесс, но при этом используется много воды — примерно 500 000 галлонов на тонну лития. В чилийском Салар-де-Атакама горнодобывающая деятельность потребляла 65 процентов воды региона.Это оказывает большое влияние на местных фермеров, которые выращивают лебеду и пасут лам, в районе, где некоторым общинам уже приходится получать воду из других мест.
Существует также возможность, как это произошло в Тибете, утечки токсичных химических веществ из бассейнов испарения в систему водоснабжения. К ним относятся химические вещества, в том числе соляная кислота, которые используются при переработке лития в форму, пригодную для продажи, а также те отходы, которые отфильтровываются из рассола на каждой стадии.В Австралии и Северной Америке литий добывают из горных пород с использованием более традиционных методов, но для его извлечения в полезной форме по-прежнему требуются химические вещества. Исследования в Неваде выявили воздействие на рыбу на расстоянии до 150 миль вниз по течению от предприятия по переработке лития.
Рио-Гранде, Боливия. Вид с воздуха на минеральные образования вдоль дельты Рио-Гранде, на краях солончаков. Дельта в основном сухая из-за последствий добычи лития, которая сильно зависит от воды для своих неглубоких искусственных солончаков или прудов-испарителей, в которых солевые растворы оставляют высыхать в течение нескольких месяцев, оставляя минералы позади.Это высыхание дельты привело к нестабильности уровня воды как на поверхности, так и под ней. Река является домом для большого разнообразия пресноводных рыб, многие из которых происходят из бассейна Амазонки Матьяж Кривич/ИНСТИТУТ Сравнение типов аккумуляторов общего пользования
Кислотные и щелочные
Аккумуляторы часто классифицируют по типу электролита, используемого в их конструкции. Есть три общие классификации; кислые, слабокислые и щелочные.
Аккумуляторы на кислотной основе часто используют серную кислоту в качестве основного компонента электролита. Автомобильные аккумуляторы имеют кислотную основу. Электролит, используемый в слабокислотных батареях, гораздо менее агрессивен, чем типичные кислотные батареи, и обычно включает различные соли, которые обеспечивают желаемый уровень кислотности. Недорогие бытовые батареи относятся к слабокислотным батареям.
В щелочных батареях в качестве основного компонента электролита обычно используется гидроксид натрия или гидроксид калия.Щелочные батареи часто используются в приложениях, где требуется длительная и высокая выходная мощность, например, в сотовых телефонах, портативных проигрывателях компакт-дисков и радиоприемниках, пейджерах и камерах со вспышками.
Мокрые и сухие
«Мокрые» элементы относятся к гальваническим элементам, в которых электролит находится в жидкой форме и может свободно течь внутри корпуса элемента. Влажные батареи часто чувствительны к ориентации батареи. Например, если влажная ячейка ориентирована таким образом, что вокруг одного из электродов скапливается газовый карман, ячейка не будет производить ток.Большинство автомобильных аккумуляторов представляют собой мокрые элементы.
«Сухие» элементы — это элементы, в которых используется твердый или порошкообразный электролит. В электролитах такого типа для завершения химического процесса используется влага из окружающего воздуха. Ячейки с жидким электролитом можно классифицировать как «сухие», если электролит иммобилизован каким-либо механизмом, например, путем его гелеобразования или удерживания на месте с помощью абсорбирующего вещества, такого как бумага.
В обычном использовании «сухие элементы» обычно относятся к угольно-цинковым элементам (разд.2.3.1) или цинково-щелочно-марганцево-диоксидных элементах (раздел 2.3.2), в которых электролит часто загущен или удерживается на впитывающей бумаге.
Некоторые ячейки трудно классифицировать. Например, один тип элемента предназначен для длительного хранения без электролита. Непосредственно перед тем, как от элемента потребуется питание, добавляется жидкий электролит.
Категории
Батареи можно дополнительно классифицировать по назначению. В следующих разделах обсуждаются четыре общие категории батарей; «автомобильные» батареи, «бытовые» батареи, «специальные» батареи и «другие» батареи.Каждый раздел будет посвящен общим свойствам этой категории батарей. Обратите внимание, что некоторые типы батарей (кислотные или щелочные, жидкостные или сухие) могут относиться к нескольким различным категориям. В этом руководстве типы аккумуляторов помещены в категорию в
которые они, скорее всего, будут найдены в коммерческом использовании.
Аккумуляторы для автомобилей
В этом разделе рассматриваются типы и конфигурации аккумуляторов, которые обычно используются в автомобилях. В эту категорию могут входить батареи, непосредственно приводящие в действие электродвигатели, или те, которые обеспечивают пусковую энергию для двигателей внутреннего сгорания.В эту категорию также входят большие стационарные батареи, используемые в качестве источников питания для аварийного освещения зданий, питания удаленных объектов и резервного питания компьютеров. Аккумуляторы для автомобилей обычно имеются в наличии в стандартной конструкции или могут быть
специально созданные для конкретных приложений.
Свинцово-кислотные аккумуляторы, разработанные в конце 1800-х годов, были первыми коммерчески применимыми аккумуляторами. Аккумуляторы этого типа остаются популярными, поскольку они относительно недороги в производстве. Наиболее широко известно использование свинцово-кислотных аккумуляторов в качестве автомобильных аккумуляторов.Перезаряжаемые свинцово-кислотные батареи доступны с 1950-х годов и стали наиболее широко используемым типом батарей в мире, более чем в 20 раз превышающим коэффициент использования своих ближайших конкурентов. На самом деле батарея
производство является единственным крупнейшим использованием свинца в мире1. Уравнение 1 показывает химическую реакцию в свинцово-кислотном аккумуляторе.
PbO2 + Pb + 2h3SO4 > 2PbSO4 + 2h3O
Свинцово-кислотные аккумуляторы остаются популярными, поскольку они могут вырабатывать большие или малые токи в широком диапазоне температур, имеют хороший срок хранения и жизненные циклы, а также относительно недороги в производстве и покупке. .Свинцово-кислотные аккумуляторы обычно перезаряжаемые.
Производство аккумуляторов — крупнейшее в мире использование свинца. Свинцово-кислотные батареи бывают самых разных форм и размеров, от бытовых до больших батарей для использования на подводных лодках. Наиболее заметными недостатками свинцово-кислотных аккумуляторов являются их относительно большой вес и падение напряжения при разряде (разд. 3.5).
Герметичные и залитые
В «залитых» батареях кислород, образующийся на положительном электроде, высвобождается из элемента и выбрасывается в атмосферу.Точно так же водород, образующийся на отрицательном электроде, также выбрасывается в атмосферу. Общий результат – чистая потеря воды (h3O) из клетки. Эту потерянную воду необходимо периодически восполнять. Залитые батареи должны быть вентилированы, чтобы предотвратить избыточное давление из-за накопления этих газов. Кроме того, помещение или ограждение, в котором находится батарея
необходимо вентилировать, так как концентрированная водородно-кислородная атмосфера взрывоопасна.
В герметичных батареях образующийся кислород химически соединяется со свинцом, затем с водородом на отрицательном электроде, а затем снова с реактивами в электролите для воссоздания воды.Конечным результатом является отсутствие значительной потери воды из клетки.
Аккумуляторы глубокого разряда
Аккумуляторы глубокого разряда имеют конфигурацию, аналогичную конфигурации обычных аккумуляторов, за исключением того, что они специально предназначены для длительного использования, а не для кратковременного использования с последующим коротким периодом перезарядки. Термин «глубокий цикл» чаще всего применяется к свинцово-кислотным батареям. Аккумуляторы глубокого цикла требуют более длительного времени зарядки с более низкими уровнями тока, чем это необходимо для обычных аккумуляторов.
Например, типичный автомобильный аккумулятор обычно используется для подачи короткого и интенсивного электрического тока на стартер автомобиля. Затем аккумулятор быстро заряжается электрической системой автомобиля во время работы двигателя. Типичный автомобильный аккумулятор не является аккумулятором глубокого разряда. С другой стороны, аккумулятор, который обеспечивает питанием транспортное средство для отдыха (RV), должен питать фары, небольшие бытовые приборы и другую электронику в течение длительного периода времени.
время, даже когда двигатель RV не работает.Аккумуляторы глубокого разряда больше подходят для такого типа постоянного использования.
Категории автомобильных аккумуляторов
Автомобильные свинцово-кислотные аккумуляторы далее сгруппированы (по типичному использованию) в три разные категории;
Starting-Lighting-Ignition (SLI). Как правило, эти батареи используются для коротких, быстрых импульсов и сильноточных приложений. Примером может служить автомобильная батарея, которая, как ожидается, время от времени подает большой ток на стартер двигателя.
Тяговые батареи. Тяговые батареи должны обеспечивать умеренную мощность в течение многих циклов глубокой разрядки. Одним из типичных применений тяговых батарей является обеспечение энергией небольших электромобилей, таких как тележки для гольфа. Этот тип использования батареи также называется Cycle Service.
Стационарные батареи. Стационарные батареи должны иметь длительный срок хранения и при необходимости обеспечивать ток от умеренного до высокого. Эти батареи чаще всего используются для аварийных ситуаций. Типичные области применения стационарных батарей — источники бесперебойного питания (ИБП) и аварийное освещение на лестничных клетках и в коридорах.Этот тип использования батареи также называется резервным или плавающим.
«Бытовые» батареи
«Бытовые» батареи — это батареи, которые в основном используются для питания небольших портативных устройств, таких как фонарики, радиоприемники, портативные компьютеры, игрушки и сотовые телефоны. В следующих подразделах описываются технологии для многих используемых ранее и используемых в настоящее время типов бытовых батарей. Как правило, бытовые батареи представляют собой небольшие элементы на 1,5 В, которые можно легко приобрести в готовом виде.Эти батареи бывают стандартных форм и размеров, как показано в Таблице 2.
Они также могут быть спроектированы и отлиты по индивидуальному заказу, чтобы соответствовать аккумуляторному отсеку любого размера (например, для размещения внутри сотового телефона, видеокамеры или портативного компьютера). Большая часть оставшейся части этого руководства будет посвящена конструкции, характеристикам и использованию бытовых батарей.
Различные популярные размеры бытовых батареек
Размер Форма и размеры Напряжение
D Цилиндрический, высота 61,5 мм, диаметр 34,2 мм. 1,5 В
С Цилиндрический, 50.Высота 0 мм, диаметр 26,2 мм. 1,5 В
AA Цилиндрический, высота 50,5 мм, диаметр 14,5 мм. 1,5 В
AAA Цилиндрический, высота 44,5 мм, диаметр 10,5 мм. 1,5 В
9 В Прямоугольный, высота 48,5 мм, ширина 26,5 мм, глубина 17,5 мм. 9 В
Примечание. Доступны три других стандартных размера бытовых батарей: AAAA, N и 6-вольтовые (фонарные) батареи. Подсчитано, что для 90% портативных устройств с батарейным питанием требуются батареи размеров AA, C или D.
Цинк-уголь (Z-C)
Цинк-углеродные элементы, также известные как «элементы Лекланча», широко используются из-за их относительно низкой стоимости.Уравнение ниже показывает химическую реакцию в ячейке Лекланча.
Zn + 2MnO2 + 2Nh5Cl > Zn(Nh4)2Cl2 + 2MnOOH
Это были первые широко доступные бытовые батареи. Цинк-угольные элементы состоят из катода из диоксида марганца и углерода, цинкового анода и хлорида цинка (или хлорида аммония) в качестве электролита. Как правило, угольно-цинковые элементы не подлежат перезарядке и имеют наклонную кривую разряда (т. е. уровень напряжения уменьшается по отношению к величине разряда).Цинк-угольные элементы будут производить 1,5 В, и они в основном используются для некритичных применений, таких как небольшие домашние хозяйства.
устройства, такие как фонарики и портативные персональные радиоприемники. Одним заметным недостатком таких батарей является то, что внешний защитный кожух батареи сделан из цинка. Корпус служит анодом для элемента, и в некоторых случаях, если анод окисляется неравномерно, в корпусе могут образовываться отверстия, которые допускают утечку слабокислого электролита, что может привести к повреждению питаемого устройства.
Щелочные элементы на основе диоксида цинка и марганца («Щелочные батареи»)
Когда в обычной угольно-цинковой батарее используется щелочной электролит вместо слабокислого электролита, такая батарея называется «щелочной». Срок службы щелочной батареи в 5-6 раз больше, чем у угольно-цинковой батареи. По оценкам одного производителя, 30% бытовых батарей, продаваемых сегодня в мире, представляют собой батареи из диоксида цинка и марганца (т. е. щелочные). Как и угольно-цинковые батареи, щелочные батареи обычно не перезаряжаются.
Никель-кадмиевые (Ni-Cd)
Никель-кадмиевые элементы являются наиболее часто используемыми перезаряжаемыми бытовыми батареями. Они полезны для питания небольших бытовых приборов, таких как садовые инструменты и сотовые телефоны. Основной гальванический элемент в Ni-Cd аккумуляторе содержит кадмиевый анод, катод из гидроксида никеля и щелочной электролит. Уравнение ниже показывает химическую реакцию в Ni-Cd элементе.
Cd + 2h3O + 2NiOOH > 2Ni(OH)2 + Cd(OH)2
Аккумуляторы, изготовленные из никель-кадмиевых элементов, обеспечивают высокие токи при относительно постоянном напряжении и устойчивы к физическим воздействиям.Никель-кадмиевые аккумуляторы также устойчивы к неэффективному циклу использования. Если у никель-кадмиевой батареи произошла потеря памяти (раздел 3.4), несколько циклов разрядки и перезарядки часто могут восстановить почти «полную» память батареи.
К сожалению, никель-кадмиевая технология относительно дорогая. Кадмий является дорогим металлом и токсичен. Недавние правила, ограничивающие утилизацию отходов кадмия (от производства элементов или от утилизации использованных батарей), способствовали более высоким затратам на производство и использование этих батарей.Однако у этих повышенных затрат есть одно неожиданное преимущество: переработка и повторное использование многих компонентов никель-кадмиевой батареи более рентабельно, чем переработка.
компоненты других типов аккумуляторов. Некоторые крупные производители аккумуляторов являются лидерами в таких усилиях по переработке.
Никель-металлогидридный (Ni-MH)
Разработчики аккумуляторов исследовали несколько других типов металлов, которые можно было бы использовать вместо кадмия для создания компактных и недорогих вторичных аккумуляторов высокой энергии.Никель-металлогидридная ячейка является широко используемой альтернативой. Анод Ni-MH элемента изготовлен из металлического сплава, аккумулирующего водород, катод — из оксида никеля, а электролит — из раствора гидроксида калия. По словам одного производителя, Ni-MH элементы могут служить на 40% дольше, чем те же.
размер Ni-Cd элементов и будет иметь срок службы до 600 циклов. 5 Это делает их полезными для устройств с высоким энергопотреблением, таких как портативные компьютеры, сотовые телефоны и видеокамеры. Ni-MH аккумуляторы имеют высокую скорость саморазряда и стоят относительно дорого.
Никель-железо (Ni-I)
Никель-железные элементы, также известные как батарея Эдисона, намного дешевле в производстве и утилизации, чем никель-кадмиевые элементы. Никель-железные элементы были разработаны еще до никель-кадмиевых элементов. Элементы прочны и надежны, но перезаряжаются не очень эффективно. Они широко используются в промышленности и в Восточной Европе, где железо и никель легкодоступны и недороги.
Никель-цинк (Ni-Z)
Другой альтернативой использованию кадмиевых электродов является использование цинковых электродов.Хотя никель-цинковый элемент обеспечивает многообещающую выходную мощность, элемент имеет некоторые досадные ограничения производительности, из-за которых полезный срок службы элемента не превышает 200 или около того циклов зарядки. При перезарядке никель-цинковых элементов цинк не осаждается повторно в тех же «отверстиях» на аноде, которые образовались при разряде. Вместо этого цинк переоткладывается несколько случайным образом.
электрод деформируется. Со временем это приводит к физическому ослаблению и возможному выходу из строя электрода.
Литий и литий-ион
Литий является многообещающим реагентом в аккумуляторных технологиях из-за его высокой электроположительности. Удельная энергия некоторых элементов на основе лития может быть в пять раз больше, чем у свинцово-кислотного элемента эквивалентного размера, и в три раза больше, чем у щелочных батарей.6 Литиевые элементы часто имеют начальное напряжение 3,0 В. Эти характеристики превращаются в батареи, которые легче по весу, имеют более низкие затраты на использование и имеют более высокие и стабильные профили напряжения.Уравнение
ниже показана химическая реакция в одном типе литиевого элемента.
Li + MnO2 > LiMnO2
Литий воспламеняется или взрывается при контакте с водой. К сожалению, то же самое свойство, которое делает литий привлекательным для использования в батареях, его высокий электрохимический потенциал, также может вызвать серьезные трудности при изготовлении и использовании таких батарей. Многие неорганические компоненты батареи и ее корпуса разрушаются ионами лития, и при контакте с водой литий реагирует с образованием огромных объемов водорода, который может воспламениться или создать избыточное давление.
в клетке.Многие огнетушители имеют водную основу и приведут к катастрофическим последствиям, если их использовать с литиевыми изделиями. Специальные огнетушители класса D должны использоваться, когда известно, что литий находится в пределах границ пожара. Литий также имеет относительно низкую температуру плавления для металла 180°С (356°F). Если литий расплавится, он может вступить в непосредственный контакт с катодом, вызывая бурные химические реакции.
Некоторые производители успешно используют элементы на основе сульфида лития-железа, диоксида лития-марганца, монофторида лития-углерода, оксида лития-кобальта и литий-тионила.Признавая потенциальную опасность литиевых компонентов, производители литиевых батарей предприняли значительные шаги по добавлению в батареи функций безопасности, чтобы обеспечить их безопасное использование. Литиевые первичные батареи (небольших размеров из соображений безопасности) в настоящее время продаются для использования во флэш-памяти.
камеры и компьютерная память. Литиевые батареи могут работать в три раза дольше, чем щелочные батареи того же размера. Но, поскольку стоимость литиевых батарей может быть в три раза выше стоимости щелочных батарей, экономическая выгода от использования литиевых батарей незначительна.
Литиевые батареи размером с пуговицу становятся популярными для использования в резервной памяти компьютера, в калькуляторах и часах. В таких приложениях, где замена батареи затруднена, более длительный срок службы литиевой батареи делает ее желательным выбором. Одна компания в настоящее время производит вторичные литий-ионные аккумуляторы с напряжением 3,7 В, «в четыре раза превышающим плотность энергии никель-кадмиевых аккумуляторов», «в пять раз легче никель-кадмиевых аккумуляторов», и их можно перезаряжать 500 раз. В
Как правило, вторичные (перезаряжаемые) литий-ионные батареи обладают хорошими характеристиками высокой мощности, отличным сроком службы и лучшим сроком службы, чем никель-кадмиевые батареи.К сожалению, они имеют очень высокую начальную стоимость, а общая энергия, доступная за цикл использования, несколько меньше, чем у никель-кадмиевых аккумуляторов.
Специализированные батареи («кнопочные» и миниатюрные батареи)
«Кнопочные» батареи — это название категории небольших батарей, имеющих форму монеты или пуговицы. Обычно они используются для небольших устройств, таких как фотоаппараты, калькуляторы и электронные часы.
Миниатюрные батарейки — это очень маленькие батарейки, которые можно изготовить по индивидуальному заказу для таких устройств, как слуховые аппараты и электронные «жучки», где даже кнопочные батарейки могут быть слишком большими.Промышленная стандартизация привела к появлению от 5 до 10 стандартных типов миниатюрных батареек, которые используются в производстве слуховых аппаратов. Вместе батареи-таблетки и миниатюрные батареи называются специальными батареями.
Большинству кнопочных и миниатюрных батареек требуется очень высокая плотность энергии, чтобы компенсировать их небольшой размер. Высокая плотность энергии достигается за счет использования высоко электроположительных и дорогих металлов, таких как серебро или ртуть. Эти металлы недостаточно рентабельны, чтобы их можно было использовать в батареях большего размера.
Несколько составов специальных батарей описаны в следующих разделах.
Воздушно-металлические элементы
Очень практичным способом получения высокой плотности энергии в гальваническом элементе является использование кислорода воздуха в качестве «жидкого» катода. В качестве анода используется металл, такой как цинк или алюминий. Кислородный катод восстанавливается в той части ячейки, которая физически изолирована от анода. При использовании газообразного катода больше места доступно для анода и электролита, поэтому размер ячейки может быть очень маленьким, обеспечивая при этом хороший выход энергии.Для
приложений, таких как слуховые аппараты, часы и тайные подслушивающие устройства.
Металло-воздушные ячейки имеют некоторые технические недостатки. Трудно построить и обслуживать ячейку, в которой кислород, действующий как катод, полностью изолирован от анода. Кроме того, поскольку электролит находится в прямом контакте с воздухом, примерно через 1–3 месяца после его активации электролит станет слишком сухим, чтобы химическая реакция продолжалась.Для предотвращения преждевременного высыхания ячеек на каждую ячейку при изготовлении устанавливается пломба. Эта печать
должны быть удалены покупателем перед первым использованием ячейки. В качестве альтернативы производитель может предоставить батарею в герметичной упаковке.
Оксид серебра
В элементах с оксидом серебра используется оксид серебра в качестве катода, цинк в качестве анода и гидроксид калия в качестве электролита. Элементы из оксида серебра имеют умеренно высокую плотность энергии и относительно плоский профиль напряжения.В результате их можно легко использовать для создания специальных батарей. Элементы из оксида серебра могут обеспечивать более высокие токи в течение более длительных периодов времени, чем большинство других специальных батарей, например, разработанных по технологии металл-воздух. Из-за высокой стоимости серебра оксид серебра
технология в настоящее время ограничена использованием в специальных батареях.
Оксид ртути
Элементы из оксида ртути состоят из цинкового анода, катода из оксида ртути и гидроксида калия или гидроксида натрия в качестве электролита.Элементы из оксида ртути имеют высокую плотность энергии и плоский профиль напряжения, напоминающий профиль плотности энергии и напряжения элементов из оксида серебра. Эти элементы на основе оксида ртути также идеально подходят для производства специальных батарей. Компонент ртуть, к сожалению, относительно дорог, и его утилизация создает экологические проблемы.
Прочие аккумуляторы
В этом разделе описывается аккумуляторная технология, которая недостаточно развита для того, чтобы быть доступной в готовом виде, имеет особые ограничения по использованию или непрактична для общего использования по иным причинам.
Никель-водород (Ni-H)
Никель-водородные элементы были разработаны для космической программы США. При определенных давлениях и температурах водород (который, как ни странно, относится к щелочным металлам) можно использовать в качестве активного электрода напротив никеля. Хотя в этих ячейках используется экологически привлекательная технология, относительно узкий диапазон условий, при которых их можно использовать, в сочетании с досадной летучестью водорода ограничивает долгосрочные перспективы этих ячеек для наземных целей.
использует.
Термические батареи
Термическая батарея представляет собой высокотемпературную первичную батарею из расплавленной соли. При температуре окружающей среды электролит представляет собой твердую непроводящую неорганическую соль. Когда требуется питание от батареи, зажигается внутренний пиротехнический источник тепла, чтобы расплавить твердый электролит, что позволяет электрохимически генерировать электричество в течение периодов от нескольких секунд до часа. Термобатареи полностью инертны до тех пор, пока электролит не расплавится, и поэтому обладают отличной
срок годности, не требуют технического обслуживания и могут выдерживать физические нагрузки (такие как вибрации или удары) между использованиями.
 , Нокед М., Джиллетт Э., Дуэй Дж., Рублофф Г. и Ли С. Б. (2015). Активация катода MnO 2 водным введением Mg 2+ для ионно-магниевого аккумулятора. Физ. хим. хим. физ. 17, 5256–5264. дои: 10.1039/c4cp05591h
, Нокед М., Джиллетт Э., Дуэй Дж., Рублофф Г. и Ли С. Б. (2015). Активация катода MnO 2 водным введением Mg 2+ для ионно-магниевого аккумулятора. Физ. хим. хим. физ. 17, 5256–5264. дои: 10.1039/c4cp05591h Хим. Матер. 28, 534–542. doi: 10.1021/acs.chemmater.5b03983
Хим. Матер. 28, 534–542. doi: 10.1021/acs.chemmater.5b03983 Энергия Матер. 7:1701189.doi: 10.1002/aenm.201701189
Энергия Матер. 7:1701189.doi: 10.1002/aenm.201701189 , Фань С. Л., Гао Т., Сунь В., Ма, З.H., Yang, C.Y., et al. (2017). Высоковольтные водные магниево-ионные батареи. АКЦ Цент. науч. 3, 1121–1128. doi: 10.1021/acscentsci.7b00361
, Фань С. Л., Гао Т., Сунь В., Ма, З.H., Yang, C.Y., et al. (2017). Высоковольтные водные магниево-ионные батареи. АКЦ Цент. науч. 3, 1121–1128. doi: 10.1021/acscentsci.7b00361 Материал для хранения энергии. 13, 1–7. doi: 10.1016/j.ensm.2017.12.022
Материал для хранения энергии. 13, 1–7. doi: 10.1016/j.ensm.2017.12.022 doi: 10.1038/ncomms7401
doi: 10.1038/ncomms7401 науч. 13, 503–510. дои: 10.1039/C9EE03545a
науч. 13, 503–510. дои: 10.1039/C9EE03545a , Поллард, Т. П., Лу, X. Дж., Сан, С. Дж., и др. (2019а). Водный литий-ионный аккумулятор, созданный за счет химии превращения галогенов и интеркаляции в графит. Природа 569, 245–250. doi: 10.1038/s41586-019-1175-6
, Поллард, Т. П., Лу, X. Дж., Сан, С. Дж., и др. (2019а). Водный литий-ионный аккумулятор, созданный за счет химии превращения галогенов и интеркаляции в графит. Природа 569, 245–250. doi: 10.1038/s41586-019-1175-6 Хим. коммун. 54, 14097–14099. дои: 10.1039/c8cc07730d
Хим. коммун. 54, 14097–14099. дои: 10.1039/c8cc07730d doi: 10.1016/j.elecom.2016.05.014
doi: 10.1016/j.elecom.2016.05.014 58, 14202–14207. doi: 10.1002/anie.201
58, 14202–14207. doi: 10.1002/anie.201 Сканирующий электронный микроскоп (СЭМ, дополнительный рисунок 1b) образца показывает морфологию наностержней со средней длиной 2 мкм и шириной 100–200 нм. Полиморфы наностержней α-MnO 2 и γ-MnO 2 также были синтезированы гидротермальным методом (дополнительный рисунок 2; дополнительные методы). Коммерческие порошки β-MnO 2 с крупным размером частиц ~ 2 мкм (дополнительный рис.3) использовались для сравнения.
Сканирующий электронный микроскоп (СЭМ, дополнительный рисунок 1b) образца показывает морфологию наностержней со средней длиной 2 мкм и шириной 100–200 нм. Полиморфы наностержней α-MnO 2 и γ-MnO 2 также были синтезированы гидротермальным методом (дополнительный рисунок 2; дополнительные методы). Коммерческие порошки β-MnO 2 с крупным размером частиц ~ 2 мкм (дополнительный рис.3) использовались для сравнения. Первая кривая разряда представляет собой плоское плато при напряжении около 1,08 В, в то время как второй цикл представляет собой два наклонных плато разряда, что соответствует результатам CV. Примечательно, что начальная разрядная емкость достигает 307 мАч г −1 , что приближается к теоретической емкости 308 мАч г −1 (в пересчете на MnO 2 ) и соответствует 0,5 Zn 2+ на MnO 0 2 . . Эволюция CV-профилей и плато разряда указывает на другой механизм интеркаляции Zn 2+ в электрод MnO 2 36, 43 , как обсуждается ниже.
Первая кривая разряда представляет собой плоское плато при напряжении около 1,08 В, в то время как второй цикл представляет собой два наклонных плато разряда, что соответствует результатам CV. Примечательно, что начальная разрядная емкость достигает 307 мАч г −1 , что приближается к теоретической емкости 308 мАч г −1 (в пересчете на MnO 2 ) и соответствует 0,5 Zn 2+ на MnO 0 2 . . Эволюция CV-профилей и плато разряда указывает на другой механизм интеркаляции Zn 2+ в электрод MnO 2 36, 43 , как обсуждается ниже. Точками A–J отмечены состояния, в которых были собраны данные для рентгеноструктурного анализа. c Рентгенограммы β-MnO 2 электрод в выбранных состояниях во время первого и второго циклов
Точками A–J отмечены состояния, в которых были собраны данные для рентгеноструктурного анализа. c Рентгенограммы β-MnO 2 электрод в выбранных состояниях во время первого и второго циклов 4г). Уточнение Ритвельдом данных РФА разряженного электрода предполагает образование фазы Zn-бузерита (дополнительный рисунок 4e). Точный структурный мотив Zn-бузерита еще не определен, но будет дополнительно изучен в будущем. Фаза Zn-бузерита, обычно встречающаяся в слоистом оксидном минерале Mn 44,45,46 , содержит слои H 2 O в каналах между двумя октоэдрическими плитами MnO 6 (рис. 1b), обладающими аналогичной структурой с Ca-бусерит 44 (JCPDS No.50-0015). Катионы Zn 2+ располагаются над и под вакантными позициями Mn и координируются тремя атомами O, соседними с вакансиями, и тремя атомами O из прослойки H 2 O 36, 44,45,46 . Присутствие H 2 O в выброшенных частицах было подтверждено с помощью термогравиметрического анализа (ТГА), указывающего на состав ~ 2,28 молекулярного H 2 O по формуле Zn-бузерита (дополнительный рисунок 5). В последующем процессе зарядки (D→F) интенсивность характерных пиков для слоистой фазы постепенно ослабевала при извлечении ионов Zn.
4г). Уточнение Ритвельдом данных РФА разряженного электрода предполагает образование фазы Zn-бузерита (дополнительный рисунок 4e). Точный структурный мотив Zn-бузерита еще не определен, но будет дополнительно изучен в будущем. Фаза Zn-бузерита, обычно встречающаяся в слоистом оксидном минерале Mn 44,45,46 , содержит слои H 2 O в каналах между двумя октоэдрическими плитами MnO 6 (рис. 1b), обладающими аналогичной структурой с Ca-бусерит 44 (JCPDS No.50-0015). Катионы Zn 2+ располагаются над и под вакантными позициями Mn и координируются тремя атомами O, соседними с вакансиями, и тремя атомами O из прослойки H 2 O 36, 44,45,46 . Присутствие H 2 O в выброшенных частицах было подтверждено с помощью термогравиметрического анализа (ТГА), указывающего на состав ~ 2,28 молекулярного H 2 O по формуле Zn-бузерита (дополнительный рисунок 5). В последующем процессе зарядки (D→F) интенсивность характерных пиков для слоистой фазы постепенно ослабевала при извлечении ионов Zn. Это пиковое затухание можно объяснить уменьшением концентрации рассеивающих атомов в элементарной ячейке и ослаблением взаимодействия Zn–O из-за выхода Zn. Подобное изменение интенсивности отражения (00 l ) наблюдалось на слоистых интеркаляционных электродах, таких как оксиды ванадия 9, 47 . Во втором цикле сигналы слоистого соединения обратимо усиливались/ослаблялись при введении/экстракции Zn 2+ . Присутствие β-MnO 2 можно наблюдать в первые несколько циклов, но его нельзя различить после 10 циклов (дополнительный рис.6). Мы также исследовали структурную эволюцию катодов α-MnO 2 и γ-MnO 2 . Интересно, что эти два полиморфа претерпевают фазовое превращение в слоистый Zn-бузерит при первом разряде и обратимое внедрение Zn в слоистую структуру при последующем циклировании (дополнительные рисунки 7 и 8), напоминая случай β-MnO 2 . Результаты предполагают общий механизм электродной реакции в туннельных полиморфах MnO 2 , который, насколько нам известно, впервые выяснен в слабокислых электролитах.
Это пиковое затухание можно объяснить уменьшением концентрации рассеивающих атомов в элементарной ячейке и ослаблением взаимодействия Zn–O из-за выхода Zn. Подобное изменение интенсивности отражения (00 l ) наблюдалось на слоистых интеркаляционных электродах, таких как оксиды ванадия 9, 47 . Во втором цикле сигналы слоистого соединения обратимо усиливались/ослаблялись при введении/экстракции Zn 2+ . Присутствие β-MnO 2 можно наблюдать в первые несколько циклов, но его нельзя различить после 10 циклов (дополнительный рис.6). Мы также исследовали структурную эволюцию катодов α-MnO 2 и γ-MnO 2 . Интересно, что эти два полиморфа претерпевают фазовое превращение в слоистый Zn-бузерит при первом разряде и обратимое внедрение Zn в слоистую структуру при последующем циклировании (дополнительные рисунки 7 и 8), напоминая случай β-MnO 2 . Результаты предполагают общий механизм электродной реакции в туннельных полиморфах MnO 2 , который, насколько нам известно, впервые выяснен в слабокислых электролитах.
 3g). ). В спектрах XPS энергетическое расщепление (Δ E ) пиков дублетов Mn 3 s составляет 4,7 и 5,0 эВ для исходных и разряженных электродов соответственно, что указывает на пониженную валентность Mn после введения Zn (рис. 3h). В разряженном состоянии появляется новый пик Zn 3p при 92.0 эВ, что ниже, чем у Zn(CF 3 SO 3 ) 2 (92,7 эВ), и может быть отнесено к интеркалированному Zn. Эти результаты подтверждают присутствие ионов Zn 2+ в структуре слоистого оксида марганца и исключают возможность электродных реакций, связанных с анионами CF 3 SO 3 − . Кроме того, ПЭМ-изображения электрода β-MnO 2 после различных циклов (дополнительный рисунок 10) указывают на расширение и расслоение наностержней, что связано с фазовым переходом, растворением Mn и повторным интеркалированием Zn 2+ , и будет несут потери мощности во время циклирования.
3g). ). В спектрах XPS энергетическое расщепление (Δ E ) пиков дублетов Mn 3 s составляет 4,7 и 5,0 эВ для исходных и разряженных электродов соответственно, что указывает на пониженную валентность Mn после введения Zn (рис. 3h). В разряженном состоянии появляется новый пик Zn 3p при 92.0 эВ, что ниже, чем у Zn(CF 3 SO 3 ) 2 (92,7 эВ), и может быть отнесено к интеркалированному Zn. Эти результаты подтверждают присутствие ионов Zn 2+ в структуре слоистого оксида марганца и исключают возможность электродных реакций, связанных с анионами CF 3 SO 3 − . Кроме того, ПЭМ-изображения электрода β-MnO 2 после различных циклов (дополнительный рисунок 10) указывают на расширение и расслоение наностержней, что связано с фазовым переходом, растворением Mn и повторным интеркалированием Zn 2+ , и будет несут потери мощности во время циклирования. На рисунке 4a показаны нормализованные профили Mn K-края XANES (рентгеновская структура поглощения вблизи края) электрода β-MnO 2 в выбранных состояниях в первых двух циклах. Номинальная валентность Mn была построена в зависимости от энергии возбуждения эталонных оксидов марганца, чтобы установить линейную корреляцию (рис.4б). При разрядке весь край смещается в сторону более низкой энергии, что указывает на уменьшение средней степени окисления Mn. Средняя валентность Mn в полностью разряженном состоянии оценивается в 3,6. При первой зарядке положение края немного смещается обратно в сторону более высоких энергий, а во втором цикле остается практически неизменным. Интересно, что валентность Mn должна увеличиваться/уменьшаться при интеркаляции/деинтеркаляции Zn 2+ и приближаться к 3 для полностью разряженного электрода, как и ожидалось по разряженной емкости (рис.2б). Мы постулируем, что такое неожиданное наблюдение может быть приписано к непропорциональному растворению трехвалентных видов Mn (Mn 3+ S → MN 4+ S + MN 2+ AQ ) 38, 53 .
На рисунке 4a показаны нормализованные профили Mn K-края XANES (рентгеновская структура поглощения вблизи края) электрода β-MnO 2 в выбранных состояниях в первых двух циклах. Номинальная валентность Mn была построена в зависимости от энергии возбуждения эталонных оксидов марганца, чтобы установить линейную корреляцию (рис.4б). При разрядке весь край смещается в сторону более низкой энергии, что указывает на уменьшение средней степени окисления Mn. Средняя валентность Mn в полностью разряженном состоянии оценивается в 3,6. При первой зарядке положение края немного смещается обратно в сторону более высоких энергий, а во втором цикле остается практически неизменным. Интересно, что валентность Mn должна увеличиваться/уменьшаться при интеркаляции/деинтеркаляции Zn 2+ и приближаться к 3 для полностью разряженного электрода, как и ожидалось по разряженной емкости (рис.2б). Мы постулируем, что такое неожиданное наблюдение может быть приписано к непропорциональному растворению трехвалентных видов Mn (Mn 3+ S → MN 4+ S + MN 2+ AQ ) 38, 53 . Анализ Mn с помощью атомно-эмиссионного спектрометра с индуктивно связанной плазмой (ICP-AES) свидетельствует об изменении концентрации Mn в электролите (дополнительный рисунок 11; дополнительное примечание 1). При разрядке количество растворенного Mn увеличивается и соответствует ~ 8.9% от общего марганца при полном разряде. Частичное растворение Mn в электролите является возможным объяснением заметной потери емкости при циклировании.
Анализ Mn с помощью атомно-эмиссионного спектрометра с индуктивно связанной плазмой (ICP-AES) свидетельствует об изменении концентрации Mn в электролите (дополнительный рисунок 11; дополнительное примечание 1). При разрядке количество растворенного Mn увеличивается и соответствует ~ 8.9% от общего марганца при полном разряде. Частичное растворение Mn в электролите является возможным объяснением заметной потери емкости при циклировании. Самый сильный пик, расположенный при 1,5 Å, относится к ближайшему кислороду (Mn-O) в октаэдрах MnO 6 . Пики при 2,5 и 3,0 Å относятся к Mn в октаэдрах с общими ребрами (Mn-Mn ребро ) и общими углами (Mn-Mn угол ) MnO 6 октаэдров (рис.4г), соответственно 51, 54 . Когда электрод был полностью разряжен, относительная интенсивность пика Mn-Mn угла уменьшилась в гораздо большей степени, чем у сигналов Mn-O и Mn-Mn края (дополнительный рисунок 12). Этот результат указывает на разрыв октаэдров MnO 6 с общими углами. Кроме того, пик 3,0 Å уширяется и немного смещается на большее расстояние, что связано с образованием энергопоглощающего пути Mn-O-Zn между слоистыми пластинами октоэдра MnO 6 и внедренными ионами Zn.Сравнение кристаллографической структуры β-MnO 2 и Zn-бузерита позволяет предположить, что совместное внедрение Zn 2+ и H 2 O и растворение Mn искажают каркас пиролюзита, оставляя вакансии Mn в верхние/нижележащие слои и образование слоистого Zn-бузерита.
Самый сильный пик, расположенный при 1,5 Å, относится к ближайшему кислороду (Mn-O) в октаэдрах MnO 6 . Пики при 2,5 и 3,0 Å относятся к Mn в октаэдрах с общими ребрами (Mn-Mn ребро ) и общими углами (Mn-Mn угол ) MnO 6 октаэдров (рис.4г), соответственно 51, 54 . Когда электрод был полностью разряжен, относительная интенсивность пика Mn-Mn угла уменьшилась в гораздо большей степени, чем у сигналов Mn-O и Mn-Mn края (дополнительный рисунок 12). Этот результат указывает на разрыв октаэдров MnO 6 с общими углами. Кроме того, пик 3,0 Å уширяется и немного смещается на большее расстояние, что связано с образованием энергопоглощающего пути Mn-O-Zn между слоистыми пластинами октоэдра MnO 6 и внедренными ионами Zn.Сравнение кристаллографической структуры β-MnO 2 и Zn-бузерита позволяет предположить, что совместное внедрение Zn 2+ и H 2 O и растворение Mn искажают каркас пиролюзита, оставляя вакансии Mn в верхние/нижележащие слои и образование слоистого Zn-бузерита. Этот фазовый переход из туннеля в слой является необратимым, на что указывает отсутствие восстановления спектров EXAFS при первой перезарядке. При этом уширенный пик 3,0 Å не полностью восстанавливается после второй зарядки, что можно объяснить потерей емкости (рис.2б). Примечательно, что XAS-анализ электродов α-MnO 2 и γ-MnO 2 (дополнительный рисунок 13) показывает сходное поведение с поведением β-MnO 2 , что снова указывает на общий механизм электродной реакции среди различных туннелированных MnO 2 полиморфов.
Этот фазовый переход из туннеля в слой является необратимым, на что указывает отсутствие восстановления спектров EXAFS при первой перезарядке. При этом уширенный пик 3,0 Å не полностью восстанавливается после второй зарядки, что можно объяснить потерей емкости (рис.2б). Примечательно, что XAS-анализ электродов α-MnO 2 и γ-MnO 2 (дополнительный рисунок 13) показывает сходное поведение с поведением β-MnO 2 , что снова указывает на общий механизм электродной реакции среди различных туннелированных MnO 2 полиморфов. индуцированные побочные реакции 4, 24, 55 . Как показано на рис. 1в, ячейки на основе мягкокислого электролита (3 M ZnSO 4 , pH ~ 3,4; 3 M Zn(CF 3 SO 3 ) 2 , pH ~ 3,6) показывают гораздо лучшие результаты. производительность при циклировании по сравнению с использованием электролита КОН.Между тем, элемент с использованием электролита Zn(CF 3 SO 3 ) 2 обеспечивает значительно более высокую начальную разрядную емкость, чем у ZnSO 4 (275 против 120 мАч г −1 ) при 0,65 C. аналогичное ухудшение емкости наблюдается при циклировании из-за потери активной массы. Чтобы решить эту проблему, мы предварительно добавили соли Mn 2+ в электролит, чтобы обеспечить равновесие растворения Mn 2+ из электрода MnO 2 . Путем устранения анионного эффекта в качестве добавки к электролиту был выбран Mn(CF 3 SO 3 ) 2 с концентрацией от разбавленного 0.
индуцированные побочные реакции 4, 24, 55 . Как показано на рис. 1в, ячейки на основе мягкокислого электролита (3 M ZnSO 4 , pH ~ 3,4; 3 M Zn(CF 3 SO 3 ) 2 , pH ~ 3,6) показывают гораздо лучшие результаты. производительность при циклировании по сравнению с использованием электролита КОН.Между тем, элемент с использованием электролита Zn(CF 3 SO 3 ) 2 обеспечивает значительно более высокую начальную разрядную емкость, чем у ZnSO 4 (275 против 120 мАч г −1 ) при 0,65 C. аналогичное ухудшение емкости наблюдается при циклировании из-за потери активной массы. Чтобы решить эту проблему, мы предварительно добавили соли Mn 2+ в электролит, чтобы обеспечить равновесие растворения Mn 2+ из электрода MnO 2 . Путем устранения анионного эффекта в качестве добавки к электролиту был выбран Mn(CF 3 SO 3 ) 2 с концентрацией от разбавленного 0. 01 м до насыщенного 0,1 М. Оптимизированная композиция электролита была найдена 3 м Zn (CF 3 SO 3 ) 2 + 0,1 м МН (CF 3 SO 3 ) 2 , что приводит к наивысшей кулоновской эффективности и ионной проводимости, а также к высокой емкости 225 мАч г -1 после 100 циклов (дополнительные рисунки 15 и 16).
01 м до насыщенного 0,1 М. Оптимизированная композиция электролита была найдена 3 м Zn (CF 3 SO 3 ) 2 + 0,1 м МН (CF 3 SO 3 ) 2 , что приводит к наивысшей кулоновской эффективности и ионной проводимости, а также к высокой емкости 225 мАч г -1 после 100 циклов (дополнительные рисунки 15 и 16). Специфическая мощность), сравнивая систему Zn-Mno 2 для зарегистрированных α-mno 2 3 , Δ-mno 2 56 , Zn 0.25 V 2 O 5 · NH 2 O 9 O 9 O 9 O 9 , ZN 1,86 мн 2 O 4 24 , Todorokite 37 , KCUFE (CN) 6 (CUHCF) 21 и ZN 3 [ CN) 6 ] 2 (ZnHCF) 57 катоды для водных ZIB (рис.5б). Высокая удельная энергия и удельная мощность (254 Втч кг −1 при 197 Вт кг −1 ; 110 Втч кг −1 при 5910 Вт кг −1 ) могут быть достигнуты одновременно для перспективной энергетики, что является приложения для хранения. Ячейку Zn-MnO 2 гальваностатически разряжали/заряжали при 6,50 C (рис. 5c) для оценки стабильности при длительном циклировании. Примечательно, что обратимая емкость поддерживает 135 мАч g −1 с сохранением емкости 94% в течение 2000 циклов и кулоновской эффективностью, приближающейся к 100%.
Специфическая мощность), сравнивая систему Zn-Mno 2 для зарегистрированных α-mno 2 3 , Δ-mno 2 56 , Zn 0.25 V 2 O 5 · NH 2 O 9 O 9 O 9 O 9 , ZN 1,86 мн 2 O 4 24 , Todorokite 37 , KCUFE (CN) 6 (CUHCF) 21 и ZN 3 [ CN) 6 ] 2 (ZnHCF) 57 катоды для водных ZIB (рис.5б). Высокая удельная энергия и удельная мощность (254 Втч кг −1 при 197 Вт кг −1 ; 110 Втч кг −1 при 5910 Вт кг −1 ) могут быть достигнуты одновременно для перспективной энергетики, что является приложения для хранения. Ячейку Zn-MnO 2 гальваностатически разряжали/заряжали при 6,50 C (рис. 5c) для оценки стабильности при длительном циклировании. Примечательно, что обратимая емкость поддерживает 135 мАч g −1 с сохранением емкости 94% в течение 2000 циклов и кулоновской эффективностью, приближающейся к 100%.
 Интересно, что электролит на основе CF 3 SO 3 − обладает гораздо более высокой начальной разрядной емкостью (275 мАч г −1 при 0,65 C) и приводит к стабилизации емкости после ~ 10 циклов. Различное поведение можно приписать раствору Zn (CF 3 SO 3 ) 2 , который не только обладает более высокой ионной проводимостью (дополнительный рисунок 19), но также обеспечивает более быструю кинетику и более высокую стабильность цинкового покрытия / снятия, поскольку по сравнению с сульфатными и щелочными электролитами (дополнительный рис.20; Дополнительное примечание 2). Кроме того, объемный анион CF 3 SO 3 − (по сравнению с SO 4 2− с двойным зарядом) может уменьшить количество молекул воды, окружающих катионы Zn 2+ , и уменьшить эффект сольватации. 24 , что облегчает транспорт ионов Zn 2+ и перенос заряда.
Интересно, что электролит на основе CF 3 SO 3 − обладает гораздо более высокой начальной разрядной емкостью (275 мАч г −1 при 0,65 C) и приводит к стабилизации емкости после ~ 10 циклов. Различное поведение можно приписать раствору Zn (CF 3 SO 3 ) 2 , который не только обладает более высокой ионной проводимостью (дополнительный рисунок 19), но также обеспечивает более быструю кинетику и более высокую стабильность цинкового покрытия / снятия, поскольку по сравнению с сульфатными и щелочными электролитами (дополнительный рис.20; Дополнительное примечание 2). Кроме того, объемный анион CF 3 SO 3 − (по сравнению с SO 4 2− с двойным зарядом) может уменьшить количество молекул воды, окружающих катионы Zn 2+ , и уменьшить эффект сольватации. 24 , что облегчает транспорт ионов Zn 2+ и перенос заряда. {\rm{\theta}}} = 2.{2 + }}/{\rm{Zn}}} \right)$$
{\rm{\theta}}} = 2.{2 + }}/{\rm{Zn}}} \right)$$ Слой состоит из оксида марганца со степенью окисления Mn от + 3 до + 4 и имеет морфологию нанолистов и плохую кристалличность, как было проанализировано с помощью SEM, XRD, Raman, XPS и XAENS (дополнительный рис.22).
Слой состоит из оксида марганца со степенью окисления Mn от + 3 до + 4 и имеет морфологию нанолистов и плохую кристалличность, как было проанализировано с помощью SEM, XRD, Raman, XPS и XAENS (дополнительный рис.22). ) 2 добавка (рис. 6e). Распыление электрода может нарушить электронную проводящую сеть и увеличить поляризацию электрода, что еще больше усугубит снижение емкости.Спектроскопию электрохимического импеданса (ЭИС) проводили в трехэлектродной ячейке, используя демонтированный после десяти циклов катод в качестве рабочего электрода, платиновую пластину в качестве противоэлектрода и насыщенный каломельный электрод (НКЭ) в качестве электрода сравнения. Циклический электрод в электролите с добавлением Mn 2+ имеет два вдавленных полукруга в области высоких частот и одну линию в области низких частот (рис. 6f). Подгонка данных EIS (дополнительная таблица 1) дает последовательное сопротивление ( R с , 4.5 Ом), сопротивление интерфейса ( Ом i , 6,0 Ом) между электролитом и наплавленным слоем, сопротивление переносу заряда ( R ct , 25 Ω) и импеданс диффузии Варбурга ( Z Вт , 124,7 Ом). Для сравнения, элемент без добавки электролита показывает более высокое значение R . с (8,0 Ом), R ct (350 Ом) и Z Вт (1200 Ом), при отсутствии видимой интерфейсной составляющей (рис.6г).
) 2 добавка (рис. 6e). Распыление электрода может нарушить электронную проводящую сеть и увеличить поляризацию электрода, что еще больше усугубит снижение емкости.Спектроскопию электрохимического импеданса (ЭИС) проводили в трехэлектродной ячейке, используя демонтированный после десяти циклов катод в качестве рабочего электрода, платиновую пластину в качестве противоэлектрода и насыщенный каломельный электрод (НКЭ) в качестве электрода сравнения. Циклический электрод в электролите с добавлением Mn 2+ имеет два вдавленных полукруга в области высоких частот и одну линию в области низких частот (рис. 6f). Подгонка данных EIS (дополнительная таблица 1) дает последовательное сопротивление ( R с , 4.5 Ом), сопротивление интерфейса ( Ом i , 6,0 Ом) между электролитом и наплавленным слоем, сопротивление переносу заряда ( R ct , 25 Ω) и импеданс диффузии Варбурга ( Z Вт , 124,7 Ом). Для сравнения, элемент без добавки электролита показывает более высокое значение R . с (8,0 Ом), R ct (350 Ом) и Z Вт (1200 Ом), при отсутствии видимой интерфейсной составляющей (рис.6г).Батарея будущего? Инновационная химия батареи произвела революцию в воздушно-цинковой батарее
DOI: 10.1126/science.abb9554
Сравнение типов аккумуляторов общего пользования
Кислотные и щелочные
Аккумуляторы часто классифицируют по типу электролита, используемого в их конструкции. Есть три общие классификации; кислые, слабокислые и щелочные.
Аккумуляторы на кислотной основе часто используют серную кислоту в качестве основного компонента электролита. Автомобильные аккумуляторы имеют кислотную основу. Электролит, используемый в слабокислотных батареях, гораздо менее агрессивен, чем типичные кислотные батареи, и обычно включает различные соли, которые обеспечивают желаемый уровень кислотности. Недорогие бытовые батареи относятся к слабокислотным батареям.
В щелочных батареях в качестве основного компонента электролита обычно используется гидроксид натрия или гидроксид калия.Щелочные батареи часто используются в приложениях, где требуется длительная и высокая выходная мощность, например, в сотовых телефонах, портативных проигрывателях компакт-дисков и радиоприемниках, пейджерах и камерах со вспышками.
Мокрые и сухие
«Мокрые» элементы относятся к гальваническим элементам, в которых электролит находится в жидкой форме и может свободно течь внутри корпуса элемента. Влажные батареи часто чувствительны к ориентации батареи. Например, если влажная ячейка ориентирована таким образом, что вокруг одного из электродов скапливается газовый карман, ячейка не будет производить ток.Большинство автомобильных аккумуляторов представляют собой мокрые элементы.
«Сухие» элементы — это элементы, в которых используется твердый или порошкообразный электролит. В электролитах такого типа для завершения химического процесса используется влага из окружающего воздуха. Ячейки с жидким электролитом можно классифицировать как «сухие», если электролит иммобилизован каким-либо механизмом, например, путем его гелеобразования или удерживания на месте с помощью абсорбирующего вещества, такого как бумага.
В обычном использовании «сухие элементы» обычно относятся к угольно-цинковым элементам (разд.2.3.1) или цинково-щелочно-марганцево-диоксидных элементах (раздел 2.3.2), в которых электролит часто загущен или удерживается на впитывающей бумаге.
Некоторые ячейки трудно классифицировать. Например, один тип элемента предназначен для длительного хранения без электролита. Непосредственно перед тем, как от элемента потребуется питание, добавляется жидкий электролит.
Категории
Батареи можно дополнительно классифицировать по назначению. В следующих разделах обсуждаются четыре общие категории батарей; «автомобильные» батареи, «бытовые» батареи, «специальные» батареи и «другие» батареи.Каждый раздел будет посвящен общим свойствам этой категории батарей. Обратите внимание, что некоторые типы батарей (кислотные или щелочные, жидкостные или сухие) могут относиться к нескольким различным категориям. В этом руководстве типы аккумуляторов помещены в категорию в
которые они, скорее всего, будут найдены в коммерческом использовании.
Аккумуляторы для автомобилей
В этом разделе рассматриваются типы и конфигурации аккумуляторов, которые обычно используются в автомобилях. В эту категорию могут входить батареи, непосредственно приводящие в действие электродвигатели, или те, которые обеспечивают пусковую энергию для двигателей внутреннего сгорания.В эту категорию также входят большие стационарные батареи, используемые в качестве источников питания для аварийного освещения зданий, питания удаленных объектов и резервного питания компьютеров. Аккумуляторы для автомобилей обычно имеются в наличии в стандартной конструкции или могут быть
специально созданные для конкретных приложений.
Свинцово-кислотные аккумуляторы, разработанные в конце 1800-х годов, были первыми коммерчески применимыми аккумуляторами. Аккумуляторы этого типа остаются популярными, поскольку они относительно недороги в производстве. Наиболее широко известно использование свинцово-кислотных аккумуляторов в качестве автомобильных аккумуляторов.Перезаряжаемые свинцово-кислотные батареи доступны с 1950-х годов и стали наиболее широко используемым типом батарей в мире, более чем в 20 раз превышающим коэффициент использования своих ближайших конкурентов. На самом деле батарея
производство является единственным крупнейшим использованием свинца в мире1. Уравнение 1 показывает химическую реакцию в свинцово-кислотном аккумуляторе.
PbO2 + Pb + 2h3SO4 > 2PbSO4 + 2h3O
Свинцово-кислотные аккумуляторы остаются популярными, поскольку они могут вырабатывать большие или малые токи в широком диапазоне температур, имеют хороший срок хранения и жизненные циклы, а также относительно недороги в производстве и покупке. .Свинцово-кислотные аккумуляторы обычно перезаряжаемые.
Производство аккумуляторов — крупнейшее в мире использование свинца. Свинцово-кислотные батареи бывают самых разных форм и размеров, от бытовых до больших батарей для использования на подводных лодках. Наиболее заметными недостатками свинцово-кислотных аккумуляторов являются их относительно большой вес и падение напряжения при разряде (разд. 3.5).
Герметичные и залитые
В «залитых» батареях кислород, образующийся на положительном электроде, высвобождается из элемента и выбрасывается в атмосферу.Точно так же водород, образующийся на отрицательном электроде, также выбрасывается в атмосферу. Общий результат – чистая потеря воды (h3O) из клетки. Эту потерянную воду необходимо периодически восполнять. Залитые батареи должны быть вентилированы, чтобы предотвратить избыточное давление из-за накопления этих газов. Кроме того, помещение или ограждение, в котором находится батарея
необходимо вентилировать, так как концентрированная водородно-кислородная атмосфера взрывоопасна.
В герметичных батареях образующийся кислород химически соединяется со свинцом, затем с водородом на отрицательном электроде, а затем снова с реактивами в электролите для воссоздания воды.Конечным результатом является отсутствие значительной потери воды из клетки.
Аккумуляторы глубокого разряда
Аккумуляторы глубокого разряда имеют конфигурацию, аналогичную конфигурации обычных аккумуляторов, за исключением того, что они специально предназначены для длительного использования, а не для кратковременного использования с последующим коротким периодом перезарядки. Термин «глубокий цикл» чаще всего применяется к свинцово-кислотным батареям. Аккумуляторы глубокого цикла требуют более длительного времени зарядки с более низкими уровнями тока, чем это необходимо для обычных аккумуляторов.
Например, типичный автомобильный аккумулятор обычно используется для подачи короткого и интенсивного электрического тока на стартер автомобиля. Затем аккумулятор быстро заряжается электрической системой автомобиля во время работы двигателя. Типичный автомобильный аккумулятор не является аккумулятором глубокого разряда. С другой стороны, аккумулятор, который обеспечивает питанием транспортное средство для отдыха (RV), должен питать фары, небольшие бытовые приборы и другую электронику в течение длительного периода времени.
время, даже когда двигатель RV не работает.Аккумуляторы глубокого разряда больше подходят для такого типа постоянного использования.
Категории автомобильных аккумуляторов
Автомобильные свинцово-кислотные аккумуляторы далее сгруппированы (по типичному использованию) в три разные категории;
Starting-Lighting-Ignition (SLI). Как правило, эти батареи используются для коротких, быстрых импульсов и сильноточных приложений. Примером может служить автомобильная батарея, которая, как ожидается, время от времени подает большой ток на стартер двигателя.
Тяговые батареи. Тяговые батареи должны обеспечивать умеренную мощность в течение многих циклов глубокой разрядки. Одним из типичных применений тяговых батарей является обеспечение энергией небольших электромобилей, таких как тележки для гольфа. Этот тип использования батареи также называется Cycle Service.
Стационарные батареи. Стационарные батареи должны иметь длительный срок хранения и при необходимости обеспечивать ток от умеренного до высокого. Эти батареи чаще всего используются для аварийных ситуаций. Типичные области применения стационарных батарей — источники бесперебойного питания (ИБП) и аварийное освещение на лестничных клетках и в коридорах.Этот тип использования батареи также называется резервным или плавающим.
«Бытовые» батареи
«Бытовые» батареи — это батареи, которые в основном используются для питания небольших портативных устройств, таких как фонарики, радиоприемники, портативные компьютеры, игрушки и сотовые телефоны. В следующих подразделах описываются технологии для многих используемых ранее и используемых в настоящее время типов бытовых батарей. Как правило, бытовые батареи представляют собой небольшие элементы на 1,5 В, которые можно легко приобрести в готовом виде.Эти батареи бывают стандартных форм и размеров, как показано в Таблице 2.
Они также могут быть спроектированы и отлиты по индивидуальному заказу, чтобы соответствовать аккумуляторному отсеку любого размера (например, для размещения внутри сотового телефона, видеокамеры или портативного компьютера). Большая часть оставшейся части этого руководства будет посвящена конструкции, характеристикам и использованию бытовых батарей.
Различные популярные размеры бытовых батареек
Размер Форма и размеры Напряжение
D Цилиндрический, высота 61,5 мм, диаметр 34,2 мм. 1,5 В
С Цилиндрический, 50.Высота 0 мм, диаметр 26,2 мм. 1,5 В
AA Цилиндрический, высота 50,5 мм, диаметр 14,5 мм. 1,5 В
AAA Цилиндрический, высота 44,5 мм, диаметр 10,5 мм. 1,5 В
9 В Прямоугольный, высота 48,5 мм, ширина 26,5 мм, глубина 17,5 мм. 9 В
Примечание. Доступны три других стандартных размера бытовых батарей: AAAA, N и 6-вольтовые (фонарные) батареи. Подсчитано, что для 90% портативных устройств с батарейным питанием требуются батареи размеров AA, C или D.
Цинк-уголь (Z-C)
Цинк-углеродные элементы, также известные как «элементы Лекланча», широко используются из-за их относительно низкой стоимости.Уравнение ниже показывает химическую реакцию в ячейке Лекланча.
Zn + 2MnO2 + 2Nh5Cl > Zn(Nh4)2Cl2 + 2MnOOH
Это были первые широко доступные бытовые батареи. Цинк-угольные элементы состоят из катода из диоксида марганца и углерода, цинкового анода и хлорида цинка (или хлорида аммония) в качестве электролита. Как правило, угольно-цинковые элементы не подлежат перезарядке и имеют наклонную кривую разряда (т. е. уровень напряжения уменьшается по отношению к величине разряда).Цинк-угольные элементы будут производить 1,5 В, и они в основном используются для некритичных применений, таких как небольшие домашние хозяйства.
устройства, такие как фонарики и портативные персональные радиоприемники. Одним заметным недостатком таких батарей является то, что внешний защитный кожух батареи сделан из цинка. Корпус служит анодом для элемента, и в некоторых случаях, если анод окисляется неравномерно, в корпусе могут образовываться отверстия, которые допускают утечку слабокислого электролита, что может привести к повреждению питаемого устройства.
Щелочные элементы на основе диоксида цинка и марганца («Щелочные батареи»)
Когда в обычной угольно-цинковой батарее используется щелочной электролит вместо слабокислого электролита, такая батарея называется «щелочной». Срок службы щелочной батареи в 5-6 раз больше, чем у угольно-цинковой батареи. По оценкам одного производителя, 30% бытовых батарей, продаваемых сегодня в мире, представляют собой батареи из диоксида цинка и марганца (т. е. щелочные). Как и угольно-цинковые батареи, щелочные батареи обычно не перезаряжаются.
Никель-кадмиевые (Ni-Cd)
Никель-кадмиевые элементы являются наиболее часто используемыми перезаряжаемыми бытовыми батареями. Они полезны для питания небольших бытовых приборов, таких как садовые инструменты и сотовые телефоны. Основной гальванический элемент в Ni-Cd аккумуляторе содержит кадмиевый анод, катод из гидроксида никеля и щелочной электролит. Уравнение ниже показывает химическую реакцию в Ni-Cd элементе.
Cd + 2h3O + 2NiOOH > 2Ni(OH)2 + Cd(OH)2
Аккумуляторы, изготовленные из никель-кадмиевых элементов, обеспечивают высокие токи при относительно постоянном напряжении и устойчивы к физическим воздействиям.Никель-кадмиевые аккумуляторы также устойчивы к неэффективному циклу использования. Если у никель-кадмиевой батареи произошла потеря памяти (раздел 3.4), несколько циклов разрядки и перезарядки часто могут восстановить почти «полную» память батареи.
К сожалению, никель-кадмиевая технология относительно дорогая. Кадмий является дорогим металлом и токсичен. Недавние правила, ограничивающие утилизацию отходов кадмия (от производства элементов или от утилизации использованных батарей), способствовали более высоким затратам на производство и использование этих батарей.Однако у этих повышенных затрат есть одно неожиданное преимущество: переработка и повторное использование многих компонентов никель-кадмиевой батареи более рентабельно, чем переработка.
компоненты других типов аккумуляторов. Некоторые крупные производители аккумуляторов являются лидерами в таких усилиях по переработке.
Никель-металлогидридный (Ni-MH)
Разработчики аккумуляторов исследовали несколько других типов металлов, которые можно было бы использовать вместо кадмия для создания компактных и недорогих вторичных аккумуляторов высокой энергии.Никель-металлогидридная ячейка является широко используемой альтернативой. Анод Ni-MH элемента изготовлен из металлического сплава, аккумулирующего водород, катод — из оксида никеля, а электролит — из раствора гидроксида калия. По словам одного производителя, Ni-MH элементы могут служить на 40% дольше, чем те же.
размер Ni-Cd элементов и будет иметь срок службы до 600 циклов. 5 Это делает их полезными для устройств с высоким энергопотреблением, таких как портативные компьютеры, сотовые телефоны и видеокамеры. Ni-MH аккумуляторы имеют высокую скорость саморазряда и стоят относительно дорого.
Никель-железо (Ni-I)
Никель-железные элементы, также известные как батарея Эдисона, намного дешевле в производстве и утилизации, чем никель-кадмиевые элементы. Никель-железные элементы были разработаны еще до никель-кадмиевых элементов. Элементы прочны и надежны, но перезаряжаются не очень эффективно. Они широко используются в промышленности и в Восточной Европе, где железо и никель легкодоступны и недороги.
Никель-цинк (Ni-Z)
Другой альтернативой использованию кадмиевых электродов является использование цинковых электродов.Хотя никель-цинковый элемент обеспечивает многообещающую выходную мощность, элемент имеет некоторые досадные ограничения производительности, из-за которых полезный срок службы элемента не превышает 200 или около того циклов зарядки. При перезарядке никель-цинковых элементов цинк не осаждается повторно в тех же «отверстиях» на аноде, которые образовались при разряде. Вместо этого цинк переоткладывается несколько случайным образом.
электрод деформируется. Со временем это приводит к физическому ослаблению и возможному выходу из строя электрода.
Литий и литий-ион
Литий является многообещающим реагентом в аккумуляторных технологиях из-за его высокой электроположительности. Удельная энергия некоторых элементов на основе лития может быть в пять раз больше, чем у свинцово-кислотного элемента эквивалентного размера, и в три раза больше, чем у щелочных батарей.6 Литиевые элементы часто имеют начальное напряжение 3,0 В. Эти характеристики превращаются в батареи, которые легче по весу, имеют более низкие затраты на использование и имеют более высокие и стабильные профили напряжения.Уравнение
ниже показана химическая реакция в одном типе литиевого элемента.
Li + MnO2 > LiMnO2
Литий воспламеняется или взрывается при контакте с водой. К сожалению, то же самое свойство, которое делает литий привлекательным для использования в батареях, его высокий электрохимический потенциал, также может вызвать серьезные трудности при изготовлении и использовании таких батарей. Многие неорганические компоненты батареи и ее корпуса разрушаются ионами лития, и при контакте с водой литий реагирует с образованием огромных объемов водорода, который может воспламениться или создать избыточное давление.
в клетке.Многие огнетушители имеют водную основу и приведут к катастрофическим последствиям, если их использовать с литиевыми изделиями. Специальные огнетушители класса D должны использоваться, когда известно, что литий находится в пределах границ пожара. Литий также имеет относительно низкую температуру плавления для металла 180°С (356°F). Если литий расплавится, он может вступить в непосредственный контакт с катодом, вызывая бурные химические реакции.
Некоторые производители успешно используют элементы на основе сульфида лития-железа, диоксида лития-марганца, монофторида лития-углерода, оксида лития-кобальта и литий-тионила.Признавая потенциальную опасность литиевых компонентов, производители литиевых батарей предприняли значительные шаги по добавлению в батареи функций безопасности, чтобы обеспечить их безопасное использование. Литиевые первичные батареи (небольших размеров из соображений безопасности) в настоящее время продаются для использования во флэш-памяти.
камеры и компьютерная память. Литиевые батареи могут работать в три раза дольше, чем щелочные батареи того же размера. Но, поскольку стоимость литиевых батарей может быть в три раза выше стоимости щелочных батарей, экономическая выгода от использования литиевых батарей незначительна.
Литиевые батареи размером с пуговицу становятся популярными для использования в резервной памяти компьютера, в калькуляторах и часах. В таких приложениях, где замена батареи затруднена, более длительный срок службы литиевой батареи делает ее желательным выбором. Одна компания в настоящее время производит вторичные литий-ионные аккумуляторы с напряжением 3,7 В, «в четыре раза превышающим плотность энергии никель-кадмиевых аккумуляторов», «в пять раз легче никель-кадмиевых аккумуляторов», и их можно перезаряжать 500 раз. В
Как правило, вторичные (перезаряжаемые) литий-ионные батареи обладают хорошими характеристиками высокой мощности, отличным сроком службы и лучшим сроком службы, чем никель-кадмиевые батареи.К сожалению, они имеют очень высокую начальную стоимость, а общая энергия, доступная за цикл использования, несколько меньше, чем у никель-кадмиевых аккумуляторов.
Специализированные батареи («кнопочные» и миниатюрные батареи)
«Кнопочные» батареи — это название категории небольших батарей, имеющих форму монеты или пуговицы. Обычно они используются для небольших устройств, таких как фотоаппараты, калькуляторы и электронные часы.
Миниатюрные батарейки — это очень маленькие батарейки, которые можно изготовить по индивидуальному заказу для таких устройств, как слуховые аппараты и электронные «жучки», где даже кнопочные батарейки могут быть слишком большими.Промышленная стандартизация привела к появлению от 5 до 10 стандартных типов миниатюрных батареек, которые используются в производстве слуховых аппаратов. Вместе батареи-таблетки и миниатюрные батареи называются специальными батареями.
Большинству кнопочных и миниатюрных батареек требуется очень высокая плотность энергии, чтобы компенсировать их небольшой размер. Высокая плотность энергии достигается за счет использования высоко электроположительных и дорогих металлов, таких как серебро или ртуть. Эти металлы недостаточно рентабельны, чтобы их можно было использовать в батареях большего размера.
Несколько составов специальных батарей описаны в следующих разделах.
Воздушно-металлические элементы
Очень практичным способом получения высокой плотности энергии в гальваническом элементе является использование кислорода воздуха в качестве «жидкого» катода. В качестве анода используется металл, такой как цинк или алюминий. Кислородный катод восстанавливается в той части ячейки, которая физически изолирована от анода. При использовании газообразного катода больше места доступно для анода и электролита, поэтому размер ячейки может быть очень маленьким, обеспечивая при этом хороший выход энергии.Для
приложений, таких как слуховые аппараты, часы и тайные подслушивающие устройства.
Металло-воздушные ячейки имеют некоторые технические недостатки. Трудно построить и обслуживать ячейку, в которой кислород, действующий как катод, полностью изолирован от анода. Кроме того, поскольку электролит находится в прямом контакте с воздухом, примерно через 1–3 месяца после его активации электролит станет слишком сухим, чтобы химическая реакция продолжалась.Для предотвращения преждевременного высыхания ячеек на каждую ячейку при изготовлении устанавливается пломба. Эта печать
должны быть удалены покупателем перед первым использованием ячейки. В качестве альтернативы производитель может предоставить батарею в герметичной упаковке.
Оксид серебра
В элементах с оксидом серебра используется оксид серебра в качестве катода, цинк в качестве анода и гидроксид калия в качестве электролита. Элементы из оксида серебра имеют умеренно высокую плотность энергии и относительно плоский профиль напряжения.В результате их можно легко использовать для создания специальных батарей. Элементы из оксида серебра могут обеспечивать более высокие токи в течение более длительных периодов времени, чем большинство других специальных батарей, например, разработанных по технологии металл-воздух. Из-за высокой стоимости серебра оксид серебра
технология в настоящее время ограничена использованием в специальных батареях.
Оксид ртути
Элементы из оксида ртути состоят из цинкового анода, катода из оксида ртути и гидроксида калия или гидроксида натрия в качестве электролита.Элементы из оксида ртути имеют высокую плотность энергии и плоский профиль напряжения, напоминающий профиль плотности энергии и напряжения элементов из оксида серебра. Эти элементы на основе оксида ртути также идеально подходят для производства специальных батарей. Компонент ртуть, к сожалению, относительно дорог, и его утилизация создает экологические проблемы.
Прочие аккумуляторы
В этом разделе описывается аккумуляторная технология, которая недостаточно развита для того, чтобы быть доступной в готовом виде, имеет особые ограничения по использованию или непрактична для общего использования по иным причинам.
Никель-водород (Ni-H)
Никель-водородные элементы были разработаны для космической программы США. При определенных давлениях и температурах водород (который, как ни странно, относится к щелочным металлам) можно использовать в качестве активного электрода напротив никеля. Хотя в этих ячейках используется экологически привлекательная технология, относительно узкий диапазон условий, при которых их можно использовать, в сочетании с досадной летучестью водорода ограничивает долгосрочные перспективы этих ячеек для наземных целей.
использует.
Термические батареи
Термическая батарея представляет собой высокотемпературную первичную батарею из расплавленной соли. При температуре окружающей среды электролит представляет собой твердую непроводящую неорганическую соль. Когда требуется питание от батареи, зажигается внутренний пиротехнический источник тепла, чтобы расплавить твердый электролит, что позволяет электрохимически генерировать электричество в течение периодов от нескольких секунд до часа. Термобатареи полностью инертны до тех пор, пока электролит не расплавится, и поэтому обладают отличной
срок годности, не требуют технического обслуживания и могут выдерживать физические нагрузки (такие как вибрации или удары) между использованиями.

 Солевая энергия!
Солевая энергия! Соответственно их возможности и цены несколько отличаются. Щелочные (на которых чаще всего написано Alkaline) хранятся дольше солевых, имеют большую емкость (при постоянном разряде обеспечивают большую емкость), меньший саморазряд при хранении. Ну конечно при этом более высокую стоимость.
Соответственно их возможности и цены несколько отличаются. Щелочные (на которых чаще всего написано Alkaline) хранятся дольше солевых, имеют большую емкость (при постоянном разряде обеспечивают большую емкость), меньший саморазряд при хранении. Ну конечно при этом более высокую стоимость. Безусловно, для каждого потребителя важно, чтобы купленные батарейки исправно выполнили свою задачу и работали как можно дольше. Поскольку различные электроприборы, нуждающиеся в батареях, потребляют разные нагрузки, мы условно разделили их на 3 категории:
Безусловно, для каждого потребителя важно, чтобы купленные батарейки исправно выполнили свою задачу и работали как можно дольше. Поскольку различные электроприборы, нуждающиеся в батареях, потребляют разные нагрузки, мы условно разделили их на 3 категории: 05 мин («Эксперт»). Оценки соответственно равномерно разделяются в зависимости от показателя.
05 мин («Эксперт»). Оценки соответственно равномерно разделяются в зависимости от показателя.
 Что каждый потребитель
может заметить при работе аккумулятора мобильного телефона на морозе.
Т.е. для работы низкая температура плохо, а для хранения хорошо.
Что каждый потребитель
может заметить при работе аккумулятора мобильного телефона на морозе.
Т.е. для работы низкая температура плохо, а для хранения хорошо. ..
.. Харьков / Китай
Харьков / Китай )2 / к-во в упаковке /
)2 / к-во в упаковке /  : не содержат ртуть и кадмий
: не содержат ртуть и кадмий п.)
п.)


 Цена может
отличаться в зависимости от магазина
Цена может
отличаться в зависимости от магазина Киев / Польша
Киев / Польша )2 / к-во в упаковке /
)2 / к-во в упаковке /  : не заряжать, не бросать в огонь; не разбирать; не устанавливать
одновременно новые и старые батарейки, разных типов, марок и систем;
соблюдать полярность
: не заряжать, не бросать в огонь; не разбирать; не устанавливать
одновременно новые и старые батарейки, разных типов, марок и систем;
соблюдать полярность



 Цена может
отличаться в зависимости от магазина
Цена может
отличаться в зависимости от магазина Основываясь на показаниях и вариантах, выберите тот, который вы считаете наиболее удобным.
Основываясь на показаниях и вариантах, выберите тот, который вы считаете наиболее удобным.
 3
3