Все на зарядку! – Огонек № 11 (4987) от 12.03.2007
Плееры, игрушки, пульты дистанционного управления — все они превращаются в хлам, как только сели батарейки
Всеволод БЕЛЬЧЕНКО
Пальчиковые батарейки — один из самых ходовых товаров. Каждый год в мире продается более 30 миллиардов батареек, а оборот отрасли составляет десятки миллиардов долларов. Меняется и структура рынка: если раньше большинство продаж приходилось на дешевые солевые батарейки, то теперь место под солнцем захватывают их более дорогие и долговечные щелочные аналоги. За последние несколько лет их доля на российском рынке выросла с 20 до 63,1 процента. Появляются и новые, более мощные разновидности батареек, например литиевые и Oxyride. «Огонек» выяснил, как правильно подобрать батарейку для любимой техники и при этом не переплатить за дополнительные навороты.
— Батарейку нужно выбирать, исходя из мощности приборов, в которых ее будут использовать, — говорит Максим Дребежков, менеджер компании Battery Team. — Например, в гаджетах с большим потреблением тока, мр3-плеерах и фотокамерах стоит использовать щелочные элементы питания, а для экономичных устройств — пультов дистанционного управления, часов — можно купить дешевые солевые батарейки.
Такое разделение понятно, ведь мощность щелочных батареек в 6 — 8 раз превосходит их солевые аналоги. Однако дело не только в этом.
— Например, элементы питания, работающие в фотокамерах, должны обладать достаточной мощностью и выдерживать большие колебания в энергопотреблении, — уточняет Марина Семенова, менеджер по маркетингу российского представительства компании Varta. — Например, обеспечивать максимальное количество энергии во время съемки и срабатывания вспышки и тут же восстанавливаться для показа снимка на дисплее. Солевые батарейки такими качествами не обладают, так что в лучшем случае их хватит буквально на пару снимков.
Специально для фотокамер некоторые производители выпускают модифицированные щелочные батарейки Oxyride. Они лучше выдерживают пиковые нагрузки и быстрее восстанавливаются, правда, стоят в разы дороже обычных щелочных элементов питания.
Они лучше выдерживают пиковые нагрузки и быстрее восстанавливаются, правда, стоят в разы дороже обычных щелочных элементов питания.
Отличить солевые батарейки от щелочных можно по маркировке. Так, на упаковке с солевыми элементами питания будет стоять пометка Normal или Standard, а на блистере с щелочными батарейками — Alkaline. А вот определить качество батареек по их внешнему виду практически невозможно. Не стоит также безраздельно полагаться на известные марки. Ведь почти все батарейки популярных марок, поступающие в Россию, производят в Китае.
Покупатели батареек должны помнить и о правилах безопасности. Старые солевые элементы питания можно было легко «подзарядить» с помощью зажигалки. С щелочными батарейками этого делать не стоит: они могут просто взорваться. То же произойдет и при попытке подключить батарейки к зарядному устройству, предназначенному для подзарядки аккумуляторов. Разряженные солевые батарейки нельзя оставлять внутри приборов: они могут потечь и испортить технику.
Фото EAST NEWS
Солевые батарейки или алкалиновые. Что предпочесть
В магазинах можно встретить очень дешёвые соляные батарейки и значительно более дорогие алкалиновые. В чём причина разницы в цене? Чем различаются эти два вида компактных источников тока. Что лучше покупать солевые батарейки или алкалиновые? Ответы на эти вопросы вы найдёте в данной статье.
Солевые батарейки маркируются, как “R”, в частности, солевая пальчиковая, как R6.
У алкалиновых батареек на маркировке имеется буква “L”, например LR6 обозначает алкалиновую пальчиковую батарейку. На корпусе у щелочных имеется надпись «Alkaline». Последнее слово и переводится с английского, как «щёлочь».
Никелированный корпус щелочной батарейки служит токоотводом положительно заряженного электрода.
Алкалиновые батарейки сохраняют свою пригодность для использования в среднем 3-5 лет, соляные – не больше двух.
Устройствами на щелочных батарейках без проблем можно пользоваться на морозе, работоспособность соляных при отрицательных температурах стремится к нулю.
По удельной ёмкости соляные батарейки уступают щелочным в несколько раз, при малоточной нагрузке, в 4-10 раз.
Соляные батарейки могут использоваться только для приборов с малым электропотреблением, например, в настенных часах, или пульте ДУ.
Щелочные батарейки допускают перезарядку, по крайней мере, не взрываются вовремя её проведения и работают после такой процедуры значительный срок. Попытки перезарядить солевые батарейки, категорически запрещены, т. к. последние при этом взрываются.
Если солевые батарейки такие плохие, то зачем их выпускают?
Всё упирается в простоту производства, его низкую себестоимость и, как следствие, цену. Ну, и ещё в стремление граждан сэкономить даже копейки. Как говорилось выше, для настенных часов и других устройств с малым электропотреблением солевые батарейки вполне подходят, при этом стоить будут в разы дешевле алкалиновых.
на Ваш сайт.
состав, их сходства и отличия
Практически в каждом доме есть устройства, работающие на батарейках, поэтому представить сегодня жизнь без них невозможно. До недавнего времени использовались преимущественно солевые, но ближе к концу двадцатого века начали приобретать популярность более мощные, алкалиновые батарейки.
История возникновения
Первую алкалиновую батарейку изобрели американские ученые Вольдемар Юнгнер, и Томас Эдисон в начале двадцатого века, но приобрели популярность они только к середине этого же века. В них использовалась ртуть, но в сегодняшних аналогах её содержание снижено до минимальных значений.
В чем различия солевых и алкалиновых батареек
В первую очередь эти два вида отличаются друг от друга способом работы и составом. Солевые батарейки изготавливаются с использованием солей хлоридов в виде основного электролита. В алкалиновых же вместо солевого раствора используется щелочной раствор гидрата окиси калия, поэтому их так же называют щелочными. Они имеют повышенную работоспособность благодаря использованию вместо оцинкованного корпуса порошкообразного металла. Взаимодействие катода и анода с щелочью позволило повысить в несколько раз количество производимой энергии. Самым популярным производителем алкалиновых аккумуляторов является компания Duracell.
Еще одним различием алкалиновых или солевых батареек – срок годности. Оцинкованные батарейки с использованием соли могут сохранять свою работоспособность в температурном интервале от -20 до +70 градусов по Цельсию.
Преимущества алкалиновых перед солевыми
- Одно из основных различий, срок годности – 2-3 года солевых, 5-10 алкалиновые.
- При полной разрядке первых, они приходят в непригодность, в то время как щелочные элементы питания аккумуляторы способны работать при минимальном уровне разряда.
- Диапазон температур – щелочные батарейки способны работать в мороз.
- Разница в цене – наименьшую имеют солевые АКБ, щелочные стоят в несколько раз дороже, из-за сложности изготовления и большого количества преимуществ перед первыми.
- Производительность солевой в 4-10 раз меньше чем алкалиновой.
- Наилучшие результаты алкалиновая АКБ показывает при равномерной работе и потреблении мощности, в то время как солевая лучше при сильной нагрузке.
Явным лидером считается алкалиновая батарейка, но её недостаток перечеркивает все достоинства – высокая цена может значительно ударить по кошельку.
Внимание! На батарейках алкалинового типа нанесена надпись Alkaline Battery или маркировка щелочных: LR. У солевых маркировка состоит из одной буквы – R/ Это позволяет отличить солевые батарейки от щелочных и наоборот.
Если требуется АКБ в слабое устройство, то чаще приобретают солевые, они дешевле и способны работать достаточное время в настенных часах, будильниках, пультах. Но вне зависимости от преимуществ алкалиновой аккумуляторной батареи, вне конкуренции, лидером остается, литиевая батарейка, но цена на неё превышает в несколько десятков раз аналоги других разновидностей. Солевые отличаются от щелочных в первую очередь своим составом и строением – давайте разберемся в особенностях устройства этих помощников.
Но вне зависимости от преимуществ алкалиновой аккумуляторной батареи, вне конкуренции, лидером остается, литиевая батарейка, но цена на неё превышает в несколько десятков раз аналоги других разновидностей. Солевые отличаются от щелочных в первую очередь своим составом и строением – давайте разберемся в особенностях устройства этих помощников.
Что такое солевая батарейка
В устройстве солевой батарейки используются следующие материалы: цинк в роли катода, двуокись марганца в роли анода и хлорид аммония в роли электролита.
Электрический ток вырабатывается благодаря взаимодействию электролитов, анодов и катодов. После его образования, он переносится на токосниматель внутри АКБ, а после в разные концы батарейки на электроды – что позволяет передать заряд электрического тока устройству, в котором используется солевой АКБ в роли элемента питания.
Солевая батарейка имеет мощность 1.5В. Стандартными размерами считаются АА и ААА (пальчиковый и мизинчиковый), но бывают и другие габариты: C, D, 6F22. Этот вид аккумулятора дешевле аналогов в несколько раз и имеет маленький вес, но обладает низкими энергетическими показателями. Так же солевые АКБ способны окисляться, из-за плохой герметичности.
Соляные батарейки подходят для использования в устройствах с низким энергопотреблением:
- Миниатюрных роботах, игрушках для подростков и похожих приборах.
- В слабых и средних по мощности фонариках.
- В электронных часовых механизмах различного типа, например, настенных и настольных.
- Устройствах дистанционного управления или пультах для телевизоров, ресиверов и проигрывателей;
- В небольших радиоприемниках карманного типа.
Лучшими производителями солевых аккумуляторов считаются: GP, Sanyo, Фотон, Космос, Энергия. Определить солевую батарейку можно по специальной маркировке «R» с рядом стоящей цифрой.
youtube.com/embed/icCXzGroRfA?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>Что такое алкалиновая или щелочная батарейка
В составе аккумуляторных батареек алкалинового или щелочного типа, используются: размельченный в порошок цинк в роли анода, в роли катода диоксид марганца, а электролитом является щелочной материал – гидроксид калия.
Принцип работы полностью идентичен солевой батарейке. Напряжение в алкалиновой АКБ тоже совпадает – 1.5В. К стандартным размер относятся: АА, ААА, LR20, LR14, 6F22, но существуют и другие габариты. Данный аккумулятор имеет большую емкость, переносит низкие температуры, долгий срок хранения, но стоит дороже солевого и тяжелее его.
Щелочные или алкалиновые батарейки подходят для использования в устройствах со средним и высоким энергопотреблением:
- в мощных фонариках и требовательных к электрическому заряду детских игрушках;
- различных аудиоплеерах и радиоприемниках, как карманного, так и настенного типа;
- диктофонах и карманных MP3-плеерах;
- современных фотоаппаратах и видеокамер;
- автомобильных устройствах;
- в пультах для дистанционного управления.
Лучшие производители аккумуляторов с применением щелочи: Energizer, Duracell, Toshiba, Sony. Главным отличием от солевой служит маркировка LR или надпись «alkaline battery». Но многие задаются вопросом, можно ли заряжать алкалиновые батарейки и как это делать.
Можно ли заряжать?
Зарядить солевую или алкалиновую батарейку невозможно, более того – это опасно для жизни, аккумулятор может взорваться при попытке сделать это. Единственное что можно сделать, это увеличить срок эксплуатации. В случае с солевыми – их бьют друг об друга, что позволяет элементам внутри прийти в движение и незначительно повысить заряд. Щелочные батарейки можно попробовать переставить местами – изменяя источники питания. Но пытаться зарядить не нужно – это бесполезно.
Единственное что можно сделать, это увеличить срок эксплуатации. В случае с солевыми – их бьют друг об друга, что позволяет элементам внутри прийти в движение и незначительно повысить заряд. Щелочные батарейки можно попробовать переставить местами – изменяя источники питания. Но пытаться зарядить не нужно – это бесполезно.
Важно! Обычные батарейки содержат в себе опасные элементами – поэтому с целью подзарядки их нельзя разбирать, вскрывать, делать надрезы на корпусе.
Существуют способы «реанимировать» алкалиновую батарейку – но их могут производить только специалисты с определенным уровнем знаний и умений, а также при условии наличия определенных инструментов, в том числе вольтметра.
Сходства
Не смотря на различие в составах, мощности и условий хранения, солевые и щелочные АКБ имеют ряд сходств, что часто приводит к путанице у покупателя, и он может приобрести батарейку «не того» типа:
- Одинаковые габариты и размеры – они выглядят идентично друг другу и внешних сходств между ними нет.
- Возможность использования в одних и тех же устройствах – различием будет только срок службы, обычно в несколько раз короче у солевых.
- Одинаковое напряжение в 1.5В.
- Невозможность подзарядки – заряжать можно только литиевые АКБ, если попытаться зарядить солевую или щелочную батарейку может произойти взрыв.
- Нельзя выбрасывать в мусорную урну – АКБ приносит большой вред природе и их нужно утилизировать согласно законодательству.
В развитых странах для утилизации батареек этих двух типов открываются специальные приемники отработанных элементов, в которых можно получить скидку за сдачу АКБ. На специализированном заводе аккумуляторы разбирают, извлекая все опасные вещества и элементы, с целью последующей переработки.
Ежегодно производится около 11 миллиардов аккумуляторных батареек солевого и щелочного типа. При этом всё чаще крупнейшие компании отказываются от производства первых, для возможности большего количества изготовления вторых.
Типоразмеры аккумуляторных батареек
Щелочные и солевые батарейки имеют одинаковые габариты и имеют схожие типоразмеры. Производите изготавливают несколько десятков типов различных аккумуляторов, но у современных продавцов и покупателей популярны лишь часть из них.
Пальчиковые (АА) – самые популярные аккумуляторы и наиболее распространенные на планете. Применяются в различных сферах жизни как элемент питания. Часто используются внутри устройств различных часовых механизмов, детских и подростковых игрушек, в старых пультах, фонариках различной мощности.
Мизинчиковые (ААА) – диаметр этих аккумуляторов около сантиметра, длина 44.5, а вес до 14г (зависит от производителя). Применение достаточно широкое – современные пульты для дистанционного управления, аудиоплееры, небольшие и средние по мощности фонарики, детские игрушки и миниатюрные роботы.
Монетки/Таблетки – так же популярный типоразмер, который различается в диаметре изделий от 4 до 30 миллиметров. Применяются для питания наручных пейджеров и часов, различных брелоков, пультов сигнализации, игрушек, слуховых аппаратов и других устройствах, где требуется максимально миниатюрный элемент питания.
Крона – мощный элемент питания, имеющий на выходе напряжение в 9В. При небольшом габарите, эти АКБ способны дать достаточно много электрического тока. Чаще всего применяются в пультах для дистанционного управления, точных электроизмерительных приборов, в том числе медицинских, в дорогих детских игрушках.
Бочонок – большие аккумуляторы, позволяющие обеспечивать достаточным количеством энергии приборы, которые требуют подключение к электросети. Чаще всего используются в музыкальных магнитофонах и радио приемниках, мощных фонариках, двигающихся детских игрушках.
Вывод
Батарейки с применением солевых элементов имели наибольшую популярность до 1960 года, но после того как щелочные АКБ попали на полки магазинов, alkaline battery обогнали salt battery по продажам, не смотря даже на превосходящую в несколько раз цену. Связанно это в первую очередь с повышенной мощностью, которая позволяла при одинаковом заряде в 1.5В использовать одно и тоже устройство в 5-10 раз дольше, чем при использовании солевого аккумулятора.
Связанно это в первую очередь с повышенной мощностью, которая позволяла при одинаковом заряде в 1.5В использовать одно и тоже устройство в 5-10 раз дольше, чем при использовании солевого аккумулятора.
Но возможно исчезновение с прилавков магазинов, как солевых, так и щелочных/алкалиновых аккумуляторных батарей, в связи с появлением литиевых, которые можно подзаряжать в отличии от соли и щелочи, а маркировку и уровень мощности получилось сохранить такой же. Использование батарейки в устройствах приходит к своему логическому заключению – наступает эра аккумуляторов, которые держат больший заряд, легко подзаряжаются и менее опасны для окружающей среды. Пока аккумуляторы используются только в дорогостоящих приборах, но это же было и с батарейками. Через несколько десятилетий произойдет очередной технический прорыв, который позволит производителям удешевить аккумуляторы, и они станут такими же обыденными, как солевые или щелочные батарейки.
Что такое alkaline батарейки
Когда устройство, работающее на батарейках, имеет значительную мощность, то возникает необходимость в приобретении элементов питания, которые способны обеспечивать прибор необходимым током, в течение длительного времени. Алкалиновые батарейки хорошо справляются с этой задачей, поэтому, несмотря на более высокую стоимость, они пользуются большой популярностью у покупателей.
Что из себя представляет алкалиновая батарея
Щелочной или алкалиновый(alkaline переводится с английского, как щелочь) источник питания представляет собой элемент, в котором в качестве катода применяется диоксид марганца, а анодную функцию выполняет цинковый порошок. В качестве электролита в составе этого типа батарей используется раствор гидроксида калия, который является щёлочью, что и отразилось на названии этого типа элементов питания.
Щелочные батареи могут выпускаться различных типоразмеров. Величина разности потенциалов на выводах также может существенно отличаться, поэтому прежде чем приобретать элемент питания необходимо правильно подобрать тип алкалиновой батареи.
Разновидности и типоразмеры алкалиновых (щелочных) батарей
Прежде всего щелочные батарейки различаются по типу корпуса. В основном на прилавках магазинов представлены щелочные изделия следующих типов:
Таблетки (монетки). Этот тип щелочных элементов питания представляет собой диск, диаметр которого может быть от 4,8 до 30 мм. Изделие имеет металлический корпус, поэтому могут быть успешно использованы в устройствах, работающих в неблагоприятных условиях. Компактность – основное преимущество этого типоразмера щелочных батарей, поэтому наиболее часто их устанавливают в наручные часы, брелоки сигнализаций и слуховые аппараты.
Мизинчиковые батарейки (AAA). Мизинчиковые батарейки представляют собой цилиндр, диаметр которого равен 10,5 мм. Длина изделия – 44,5 мм, а вес — около 14 г. Щелочные батарейки этого типа имеют на корпусе обозначение alkaline battery ААА, поэтому их несложно будет отличить от солевых или литиевых. Применяют мизинчиковые батарейки в фонариках, игрушках, радиоприёмниках и пультах дистанционного управления.
Пальчиковые батарейки (АА). Эта категория алкалиновых батареек является самой распространённой. Используются пальчиковые батарейки в часах, радиоприёмниках, фонариках, детских игрушках, пультах ДУ и других устройствах, где необходим значительный ток разряда при минимальных размерах элемента питания. Наиболее часто щелочные изделия этого типа выпускаются с напряжением 1,5 вольта.
Крона. Щелочная батарейка типа «Крона» представляет собой элемент питания, напряжение которого на выводах составляет 9v. Достоинства этого типа заключается в том, что при относительно небольших габаритах изделие позволяет обеспечить прибор повышенным напряжением. Элемент используется в пультах ДУ, электроизмерительных приборах, детских игрушках.
Бочонки. Большие бочонки позволяют обеспечить электроэнергией приборы, потребляющие большой ток, без подключения их к электрической сети. Наиболее часто элементы питания этого типа применяются в музыкальных проигрывателях, детских игрушках, фонариках.
Наиболее часто элементы питания этого типа применяются в музыкальных проигрывателях, детских игрушках, фонариках.
Отличить щелочную батарейку от солевой совсем несложно. На корпусе изделия должна быть маркировка LR, которая указывает на наличие щелочного электролита внутри корпуса.
Какие батарейки лучше алкалиновые или солевые
Щелочные батарейки лучше солевых изделий по многим параметрам. Прежде всего, изделия этого типа предпочитают обычным батарейкам по причине значительно большей ёмкости. Разница в продолжительности работы элементов может достигать более 5 раз.
Если необходимо использовать электрическое устройство на морозе, то в этом случае также необходимо устанавливать в прибор алкалиновые батарейки, которые эффективно работают при температуре до — 20 градусов. Солевые батарейки становятся неработоспособными при любой отрицательной температуре.
Во время сильного разряда из корпуса солевой батарейки может вытечь электролит, что может привести к порче электрического устройства. Щелочные элементы практически лишены такого недостатка.
Преимущества и недостатки алкалиновых батарей
Среди преимуществ щелочных источников питания можно назвать следующие:
- Низкий саморазряд.
- Возможность работы при отрицательной температуре воздуха.
- Продолжительный срок годности.
- Хорошо переносят относительно большие токи разряда.
- Равномерный разряд батареи.
К недостаткам этого типа батарей относятся:
- Относительно большой вес изделия.
- Высокая стоимость.
Значительно более высокая цена изделия компенсируется продолжительным периодом эксплуатации. К недостаткам таких изделий можно также невозможность использовать его повторно.
Сравнение AAA и AA
Можно ли заряжать алкалиновые батарейки
Если щелочная батарейка разрядилась, то её необходимо утилизировать. Не следует пытаться восстановить элемент питания с помощью зарядного устройства. Подобные действия могут привести к разгерметизации корпуса батареи. Разрыв изделия может привести к травмам или возгоранию, поэтому категорически запрещается заряжать алкалиновые батарейки.
Подобные действия могут привести к разгерметизации корпуса батареи. Разрыв изделия может привести к травмам или возгоранию, поэтому категорически запрещается заряжать алкалиновые батарейки.
Популярные производители и их особенности
Гарантировано приобрести качественную продукцию можно только в том случае, если покупать щелочные батарейки известных производителей. На сегодняшний день наибольшим спросом пользуются маргацево щелочные элементы следующих производителей:
- Energizer – достоинство алкалиновых элементов питания от известного американского производителя электротехники заключается в том, что изделие позволяет поддерживать необходимое напряжение в устройстве, на протяжении всего времени эксплуатации изделия.
- Duracell – щелочные элементы питания этой фирмы обладают минимальным саморазрядом и максимальной ёмкостью при стандартных размерах.
- Рanasonic – батареи этого производителя отличаются стабильной отдачей электроэнергии, а также повышенной ёмкостью и устойчивостью работы при отрицательной температуре воздуха.
- Сamelion – щелочные изделия этой фирмы производятся в Китае, но качество изделий очень достойное. Батареи Сamelion хорошо переносят глубокий разряд, и сохраняют номинальное напряжение в течение всего срока эксплуатации.
Многие производители щелочных батарей поставляют на рынок качественные изделия, поэтому можно смело приобретать элементы питания таких фирм, как gp,
smartbuy, космос, varta и др. Важно при покупке не нарваться на подделку, поэтому покупать батарейки следует только в проверенных торговых точках.
- Какая разница между солевыми и алкалиновыми батарейками
- Как выбрать соляную лампу
- Что такое бертолетовая соль
Солевые батарейки старше алкалиновых
Первую батарейку изобрел итальянский физик Алессандро Волта в 1800 году, и она была солевой. Его открытие заключалось в том, что он соединил металлические диски из цинка и серебра и намоченный солевым раствором картон. С тех пор ученые усовершенствовали дизайн и состав батареек.
С тех пор ученые усовершенствовали дизайн и состав батареек.
В 1820 году британский ученый Джон Даниэль разработал батарейки, в которых в качестве электролита можно было использовать сульфат цинка и меди. Мощность таких устройств составляла 1,1 вольт, и их могло хватить на 100 лет при использовании в дверных звонках, телефонах и других приборах.
Алкалиновые батарейки были впервые разработаны в конце 19 – начале 20 века учеными Томасом Эдисоном и Вольдемаром Юнгнером. Широкой публике они были представлены только в 1960 году. Первые продаваемые алкалиновые батарейки содержали небольшое количество ртути. В современных ее количество сокращено до минимума.
Как работают батарейки
Чтобы понять, в чем разница между алкалиновыми и солевыми батарейками, следует обратиться к общему принципу работы этих устройств. Когда к батарейке подключается прибор, происходит реакция, в результате которой появляется электрическая энергия. Такую реакцию называют электрохимической.
Внутри батарейки движутся электроны, создавая электрический ток, от которого и питаются приборы. Анод и катод разделены электролитом, то есть изолятором. Электроны собираются вокруг анода, отрицательно заряженного конца батарейки. Они перемещаются к катоду, когда два противоположных конца батарейки соединяет провод снаружи. Как только прибор отключают, соединение пропадает, а вместе с ним и электрический ток. Анод в батарейках – это цинк, а катод – диоксид магния.
Разница в работе солевых и алкалиновых батареек
Самыми распространенными солевыми батарейками являются цинковые. В цинковой солевой батарейке электролит состоит из соли – хлорида цинка.
В целом по эффективности работы алкалиновые батарейки превосходят солевые в 5-7 раз.
В отличие от солевых, в алкалиновых батарейках в качестве электролита вместо раствора соли используется раствор щелочи (гидрат окиси калия). Алкалиновые батарейки более работоспособные по сравнению с солевыми. Секрет в том, что в них вместо цинкового корпуса используется порошок из того же металла, а щелочь, взаимодействуя с катодом и анодом, производит больше энергии. Ярким примером алкалиновой батарейки является Duracell.
Секрет в том, что в них вместо цинкового корпуса используется порошок из того же металла, а щелочь, взаимодействуя с катодом и анодом, производит больше энергии. Ярким примером алкалиновой батарейки является Duracell.
Цинковые солевые батарейки работают при температуре от -20 до +70оС. Их стандартные размеры АА и ААА, и их можно использовать в самых разных устройствах, от карманных фонариков до настенных часов. Срок их годности составляет в среднем 2 года.
Средняя мощность батарейки составляет 1,5 вольта.
Щелочные (они же алкалиновые) батарейки прослужат дольше. Их можно хранить до 10 лет. Благодаря щелочному электролиту они работают лучше при низких температурах. По размерам они ничем не отличаются от солевых.
До недавнего времени алкалиновые батарейки невозможно было перезаряжать, но в последнее время это стало возможно. Такие батарейки не только можно заряжать снова и снова, но они способны удерживать заряд на многие годы. В этом большое экологическое преимущество таких батареек.
Алкалиновые батарейки лучше отвечают потребностям современного рынка, так как потребляемые им мощности постоянно возрастают.
- Почему алкалиновые батарейки работают намного дольше обычных солевых?
- Как правильно выбрать батарейку
- Zinc Chloride Battery Vs. Alkaline
- How Batteries Work, Marshall Brain, Charles W. Bryant and Clint Pumphrey
- What is an Alkaline Battery?
Почти у каждого современного человека есть устройство, работающее на батарейках или аккумуляторах: пульт, часы, фонарик, мобильный телефон или ноутбук. Всё это стало привычным, мало кто задумывается о принципах работы батареек, а между тем с момента их изобретения прошло уже более двухсот лет.
История открытия
Многие научные открытия совершаются людьми, далёкими от области, в которой открытие находит свое применение. Так было и с батарейками. Явление протекания электрического тока между разными металлами в солёной среде открыл физиолог Луиджи Гальвани, и с тех пор оно называется гальванизмом. Произошло это совершенно случайно: во время препарирования лягушек лаборант обратил внимание на подергивание их лапок при контакте со скальпелем. Инструмент был стальным, а лягушки закреплялись медными зажимами, средой при этом служили их мышцы. Таков был первый гальванический элемент. Электрический импульс возбуждал нервные окончания в лапках, что и приводило к сокращению мышц.
Произошло это совершенно случайно: во время препарирования лягушек лаборант обратил внимание на подергивание их лапок при контакте со скальпелем. Инструмент был стальным, а лягушки закреплялись медными зажимами, средой при этом служили их мышцы. Таков был первый гальванический элемент. Электрический импульс возбуждал нервные окончания в лапках, что и приводило к сокращению мышц.
Странное поведение лягушек привело к возникновению теории гальванизма, которую проверил знакомый физиолога — Алессандро Вольта. Он продолжил исследования явления и в 1800 году создал первую батарейку. Конечно, она была мало похожа на современные, и до её повседневного использования было ещё очень далеко – электроприборы в основном встречались в научных лабораториях, а обычным людям демонстрировались на цирковых представлениях как интересные диковинки.
Современные батарейки
С момента появления гальванических элементов прошло много времени, их внешний вид сильно изменился. Несмотря на перемены, принцип работы таких элементов питания остался прежним. Они по-прежнему состоят из двух электродов (анод, катод) и электролита.
С распространением первых компактных электроприборов и накоплением опыта использования батареек стали видны их преимущества и недостатки. Они были громоздкими, много весили, случались потери электролита, окисление электродов, а также скапливание соли. Началась эволюция батареек, продолжающаяся и сегодня. Элементы питания разделились на два больших класса — первичные, к которым относят гальванические элементы, и вторичные, — чаще их называют аккумуляторами. Реакции, протекающие в первичных, необратимы, в конце концов они теряют весь заряд и подлежат утилизации. Вторичные позволяют восстанавливать заряд после разрядки и повторно использовать элемент питания, цикл которого повторяется много раз.
Также элементы питания различают по типу материалов, используемых для электродов, и виду электролитов. По виду католита различают солевые и щелочные, или алкалиновые, батарейки. Что это такое, рассмотрим более подробно. Электрод, как правило, изготавливают из металла, но есть и другие способы. Долгое время в качестве электродов и электролитов пробовались разные металлы и материалы. Одни вышли из употребления из-за высокой стоимости, другие из-за токсичности (ртутные), третьи имели низкую надёжность. Но многие типы батареек остались в употреблении и используются до сих пор. Почему так происходит? Всё дело в разнообразии электроприборов — разные устройства имеют различные требования к источнику питания.
Что это такое, рассмотрим более подробно. Электрод, как правило, изготавливают из металла, но есть и другие способы. Долгое время в качестве электродов и электролитов пробовались разные металлы и материалы. Одни вышли из употребления из-за высокой стоимости, другие из-за токсичности (ртутные), третьи имели низкую надёжность. Но многие типы батареек остались в употреблении и используются до сих пор. Почему так происходит? Всё дело в разнообразии электроприборов — разные устройства имеют различные требования к источнику питания.
Одни элементы питания очень дёшевы и просты в изготовлении, например солевые батарейки в часах или пульте дистанционного управления. Они работают с небольшой нагрузкой и требования к ним минимальны. Для других важна надёжность — это автомобильные аккумуляторы, источники бесперебойного питания. Однако из-за громоздкости и большой массы их применение ограничивается транспортом и стационарными устройствами. Также необходимо сочетание надёжности и компактности для современных мобильных телефонов и ноутбуков.
Солевая батарейка
Также известна как элемент Лекланше. Датой ее изобретения принято считать 1865 год. На данный момент это самые дешёвые и производимые элементы питания. Они распространены по всему миру и используются в большинстве электроприборов с низким энергопотреблением (часы, пульты). Устройство очень простое — одним электродом служит цинковая оболочка, другим угольный стержень (поэтому их ещё называют угольно-цинковыми), а в качестве электролита – хлорид аммония, загущённый с помощью крахмала. Помимо очевидных преимуществ, солевые батарейки имеют некоторые недостатки: высыхание электролита, засоление внутренней поверхности цинковой оболочки и её окисление. При окислении оболочка становится тоньше и может разрушиться, батарейку останется только выбросить. С засолением можно бороться с помощью приборов, подающих в устройство модулированный ток, что позволяет использовать ее намного дольше.
Щелочная батарейка
Или алкалиновая батарейка, отличить от солевой ее можно по созвучной с названием надписи на корпусе — Alkaline. Если солевые используются там, где не нужен сильный ток, то в устройствах с большим энергопотреблением (цифровые камеры, приборы с электродвигателями) применяются алкалиновые батарейки. Что это такое? Почти то же, что и солевые; главное отличие — цинк распределён в виде порошка по всем объёму электролита. Это позволяет увеличить площадь контакта и повысить надёжность при большом напряжении. Благодаря этому алкалиновая батарейка дольше хранится и устойчива к низким температурам. Поэтому в приборах, для которых характерны большие перерывы в работе (например, фонарики), они применяются чаще всего.
Если солевые используются там, где не нужен сильный ток, то в устройствах с большим энергопотреблением (цифровые камеры, приборы с электродвигателями) применяются алкалиновые батарейки. Что это такое? Почти то же, что и солевые; главное отличие — цинк распределён в виде порошка по всем объёму электролита. Это позволяет увеличить площадь контакта и повысить надёжность при большом напряжении. Благодаря этому алкалиновая батарейка дольше хранится и устойчива к низким температурам. Поэтому в приборах, для которых характерны большие перерывы в работе (например, фонарики), они применяются чаще всего.
Алкалиновые батарейки – какие лучше?
Выбор источника питания зависит от элементов, в которых он используется. Для энергопотребляющих устройств, такие как фотокамера или радиоуправляемая модель, применяется алкалиновая батарейка. Если же нужно подзарядить менее энергозатратные пульт от бытовой техники или наручные часы, то, как правило, используются солевые в силу их дешевизны и долгого срока работы. В настоящее время имеется множество производителей щелочных элементов питания, но одними из самых надежных считаются алкалиновые батарейки Duracell. До недавнего времени их выпуск осуществляла компания Gilette, а после ее поглощения фирма Procter & Gamble.
Можно ли заряжать алкалиновые батарейки?
Ответ на данный вопрос – нет. В данном случае выгоднее купить новое устройство, тем более срок их годности достаточно велик. При попытке подзарядки алкалиновая батарейка начнёт нагреваться и придёт в негодность, а может и взорваться. Однако срок эксплуатации самих батареек можно увеличить – для этого попеременно меняют источники питания, давая одному из них немного «подзарядиться». Что же касается вопроса о том, можно ли заряжать алкалиновые батарейки, то ответ на него однозначно отрицательный.
Чем отличаются солевые батарейки от алкалиновых
Сегодняшнюю жизнь в мире высоких технологий сложно представить без такой простой вещи, как батарейка. Маленькое приспособление, которое способно давать ток и позволяет пользоваться многими предметами быта.
Маленькое приспособление, которое способно давать ток и позволяет пользоваться многими предметами быта.
А тем временем, батарейке уже больше 200 лет. Еще в 19 веке итальянский ученый Вольта изобрел первый элемент, состоящий из анода, катода и солевого электролита. Его именем и стала называться единица измерения напряжения электрического тока. Конечно, в те времена батарейка выглядела иначе, была громоздкой и мало где могла примениться. До наших дней она прошла большой путь и значительно видоизменилась. Кроме того, все батарейки подразделились на 2 подвида: солевые и алкалиновые (щелочные).
Что такое солевая батарейка
Устройство солевой батарейки чрезвычайно простое. Она состоит из цинкового катода, анода – двуокись марганца и электролита – хлорид аммония. Отсюда происходит само название солевая батарейка, поскольку в качестве электролита выступает соль.
Солевая батарейка
Между реагентами расположена специальная прокладка, благодаря ей ингредиенты не смешиваются, но она пропускает электролит. Между электролитом и химическими элементами анода и катода возникает реакция и выделяется электрический ток. После того как ток образовался, он переходит на токосниматели, которые расположены внутри батарейки, а затем на раздельные электроды с разных концов батарейки и в итоге передается электронному устройству.
Напряжение в такой батарейке равно 1,5 В. Стандартные размеры АА (пальчиковая) и ААА (мизинчиковая).
Кроме стандартных размеров, которые встречаются наиболее часто, используются батарейки следующего типа:
- С или LR 14 (похожа на маленький бочонок).
- D или LR 20 (большой бочонок).
- 6F22 «крона» (прямоугольная батарейка чуть меньше спичечного коробка).
Преимущества солевой батарейки:
- Маленький вес.
- Дешевизна.
- Возможно продлить срок службы если дать батарейке «отдохнуть».
Недостатки:
- Низкие энергетические показатели.

- Плохо работают при низких температурах.
- Небольшой срок хранения.
- Быстрый саморазряд.
- Плохая герметичность, окисление оболочки.
Солевые батарейки обладают интересной способностью работать еще некоторое время, после того как, казалось бы, уже не могут. Дело в том, что если вытащить батарейку из устройства, к тому же немного потрясти ее или немножко постучать по ней, то можно выровнять комки электролита, который находится внутри и использовать его до конца.
Эти недорогие батарейки с небольшой мощностью подходят для приборов, не требующих высокого токопотребления, например:
- Детские игрушки.
- Небольшие фонарики.
- Пульты телевизоров.
- Часы.
- Радиоприемники.
Лидерами в производстве солевых батареек в России являются компании Космос, Энергия, Фотон. Среди мировых производителей на первом месте Sanyo и GP.
Что такое алкалиновая (щелочная) батарейка
Алкалиновая батарейка также состоит из анода – порошкообразный цинк, катода – диоксид марганца и электролита, в качестве которого выступает гидроксид калия, который является щелочью. Следовательно, отсюда идет название и самих батареек. Алкалиновыми батарейки стали называть только потому, что на английский язык щелочь переводится как Alkaline, и на многих батарейках зарубежного производства есть эта надпись.
Алкалиновая батарейка
Принцип работы у алкалиновых батареек такой же, как и у солевых. Химические элементы анода и катода аналогично взаимодействуют посредством электролита, а вырабатываемый ток передается устройствам через токоотводы.
Появились такие батарейки в 1959 году благодаря изысканиям и научным разработкам Льюиса Урри. Напряжение 1,5 В. Стандартные размеры батареек АА и ААА, LR 14, LR 20, 6F22.
Преимущества алкалиновой батарейки:
- Большая емкость.

- Хорошо работают при средних нагрузках.
- Могут работать при низких температурах.
- Надежная герметизация.
- Низкий показатель саморазряда.
- Срок хранения до 7 лет.
Недостатки:
- Высокая цена.
- Более тяжелые.
- Когда ресурс выработан, мгновенно «умирают».
Алкалиновые батарейки применяются там, где нужно среднее и высокое токопотребление, например:
- Мощные фонари.
- Аудиоплееры.
- Диктофоны.
- Фотоаппараты и фотокамеры.
- Пульты от сигнализации.
Пальма первенства среди фирм производителей таких батареек принадлежит американским компаниям Duracell и Energizer, за ними следуют японские Sony и Toshiba.
Что общего у солевых и алкалиновых батареек
- Имеют одинаковый стандартный размер.
- Могут быть использованы в одних и тех же устройствах (но солевые выйдут из строя очень быстро).
- Одинаковое напряжение.
- И те и другие батарейки нельзя подзаряжать, это может привести к их взрыву.
- Оба типа батареек, после использования необходимо правильно утилизировать.
Сегодня все больше стран уделяют внимание утилизации солевых и алкалиновых батареек. Большинство развитых государств создают специальные пункты приема, куда можно отнести использованные элементы, а при покупке новых даже получить скидку.
Батарейки отправляются на специальные заводы, где из них извлекают опасные металлы и химические соединения, для вторичной переработки. Если этого не делать, токсичные вещества могут попасть в землю, воду, а при сжигании мусора и в воздух, а это чревато, в свою очередь, серьезными последствиями для всех живых организмов на планете.
Чем отличаются
- Емкость щелочных батареек в 2-4 раза больше чем у солевых.
- Срок службы солевых батареек в 5 раз меньше алкалиновых.

- Алкалиновые батарейки в отличие от солевых могут работать в экстремальных температурных условиях.
Ежегодно в мире продается и используется примерно 11 миллиардов батареек. Многие компании, выпускавшие ранее смешанные типы батареек, сворачивают производство солевых. Считается, что их использование в скором времени будет не целесообразно, поскольку прогресс шагает вперед, и технике требуются более мощные аккумуляторы.
В чём особенность алкалиновых батарей?
Почти у каждого современного человека есть устройство, работающее на батарейках или аккумуляторах: пульт, часы, фонарик, мобильный телефон или ноутбук. Всё это стало привычным, мало кто задумывается о принципах работы батареек, а между тем с момента их изобретения прошло уже более двухсот лет.
Многие научные открытия совершаются людьми, далёкими от области, в которой открытие находит свое применение. Так было и с батарейками. Явление протекания электрического тока между разными металлами в солёной среде открыл физиолог Луиджи Гальвани, и с тех пор оно называется гальванизмом.
Содержание статьи
Современные батареи
С момента появления гальванических элементов прошло много времени, их внешний вид сильно изменился. Несмотря на перемены, принцип работы таких элементов питания остался прежним. Они по-прежнему состоят из двух электродов (анод, катод) и электролита.
С распространением первых компактных электроприборов и накоплением опыта использования батареек стали видны их преимущества и недостатки. Они были громоздкими, много весили, случались потери электролита, окисление электродов, а также скапливание соли. Началась эволюция батареек, продолжающаяся и сегодня.
Элементы питания разделились на два больших класса
- — первичные, к которым относят гальванические элементы,
Реакции, протекающие в первичных, необратимы, в конце концов они теряют весь заряд и подлежат утилизации.
- — вторичные, чаще их называют аккумуляторами.
Вторичные позволяют восстанавливать заряд после разрядки и повторно использовать элемент питания, цикл которого повторяется много раз.
Также элементы питания различают по типу материалов, используемых для электродов, и виду электролитов. По виду католита различают солевые и щелочные, или алкалиновые, батарейки. Что это такое, рассмотрим более подробно.
Электрод, как правило, изготавливают из металла, но есть и другие способы. Долгое время в качестве электродов и электролитов пробовались разные металлы и материалы. Одни вышли из употребления из-за высокой стоимости, другие из-за токсичности (ртутные), третьи имели низкую надёжность. Но многие типы батареек остались в употреблении и используются до сих пор. Почему так происходит? Всё дело в разнообразии электроприборов — разные устройства имеют различные требования к источнику питания.
Одни элементы питания очень дёшевы и просты в изготовлении, например солевые батарейки в часах или пульте дистанционного управления. Они работают с небольшой нагрузкой и требования к ним минимальны.
Для других важна надёжность — это автомобильные аккумуляторы, источники бесперебойного питания. Однако из-за громоздкости и большой массы их применение ограничивается транспортом и стационарными устройствами. Также необходимо сочетание надёжности и компактности для современных мобильных телефонов и ноутбуков.
Солевая батарейка
Также известна как элемент Лекланше. Датой ее изобретения принято считать 1865 год. На данный момент это самые дешёвые и производимые элементы питания. Они распространены по всему миру и используются в большинстве электроприборов с низким энергопотреблением (часы, пульты).
Устройство очень простое
- — одним электродом служит цинковая оболочка,
- другим угольный стержень (поэтому их ещё называют угольно-цинковыми),
- а в качестве электролита — хлорид аммония, загущённый с помощью крахмала.
Помимо очевидных преимуществ, солевые батарейки имеют некоторые недостатки: высыхание электролита, засоление внутренней поверхности цинковой оболочки и её окисление. При окислении оболочка становится тоньше и может разрушиться, батарейку останется только выбросить. С засолением можно бороться с помощью приборов, подающих в устройство модулированный ток, что позволяет использовать ее намного дольше.
Щелочная батарейка
Или алкалиновая батарейка, отличить от солевой ее можно по созвучной с названием надписи на корпусе — Alkaline. Если солевые используются там, где не нужен сильный ток, то в устройствах с большим энергопотреблением (цифровые камеры, приборы с электродвигателями) применяются алкалиновые батарейки.
Что это такое? Почти то же, что и солевые; главное отличие — цинк распределён в виде порошка по всем объёму электролита.
Это позволяет увеличить площадь контакта и повысить надёжность при большом напряжении. Благодаря этому алкалиновая батарейка дольше хранится и устойчива к низким температурам. Поэтому в приборах, для которых характерны большие перерывы в работе (например, фонарики), они применяются чаще всего.
Какие алкалиновые батарейки лучше?
Выбор источника питания зависит от элементов, в которых он используется. Для энергопотребляющих устройств, такие как фотокамера или радиоуправляемая модель, применяется алкалиновая батарейка.
Если же нужно подзарядить менее энергозатратные пульт от бытовой техники или наручные часы, то, как правило, используются солевые в силу их дешевизны и долгого срока работы. В настоящее время имеется множество производителей щелочных элементов питания, но одними из самых надежных считаются алкалиновые батарейки Duracell. До недавнего времени их выпуск осуществляла компания Gilette, а после ее поглощения фирма Procter & Gamble.
В настоящее время имеется множество производителей щелочных элементов питания, но одними из самых надежных считаются алкалиновые батарейки Duracell. До недавнего времени их выпуск осуществляла компания Gilette, а после ее поглощения фирма Procter & Gamble.
Можно ли заряжать алкалиновые батарейки?
Ответ на данный вопрос — нет. В данном случае выгоднее купить новое устройство, тем более срок их годности достаточно велик. При попытке подзарядки алкалиновая батарейка начнёт нагреваться и придёт в негодность, а может и взорваться. Однако срок эксплуатации самих батареек можно увеличить — для этого попеременно меняют источники питания, давая одному из них немного «подзарядиться».
Что же касается вопроса о том, можно ли заряжать алкалиновые батарейки, то ответ на него однозначно отрицательный.
Батарейки маркировки “Alkaline”
Работы над улучшением потребительских свойств первичных источников тока привели в шестидесятых годах к началу производства щелочных батареек. Название этот вид батареек получил по веществу электролита – концентрированному щелочному раствору. Для производства электролита используется гидроксид калия, реже гидроксид натрия.
Сегодня щелочные батарейки часто называют алкалиновыми из-за надписи на корпусе батареек, выпущенных за рубежом “Alkaline” (щелочь). Другие участники электрохимической реакции в щелочной батарейке такие же как и у солевой батарейки – отрицательный электрод из цинка и положительный электрод из оксида марганца. Применение в качестве электролита раствора щелочи вместо раствора соли позволяет значительно улучшить эксплуатационные свойства батареек.
Характеристики
Напряжение различных типов батареек составляет от 1,5 до 12 вольт. Существуют щелочные батарейки, рассчитанные на самые различные токи разряда. Малым током разряда обладают дисковые щелочные батарейки. Батарейка в корпусе 164 имеет емкость всего 8 миллиампер-часов, а в дисковой батарейке в корпусе PX625A содержится 190 миллиампер-часов.
Ток разряда этих небольших батареек измерен при работе на нагрузку высокого сопротивления. Емкость батареек зависит от тока разряда. Это иллюстрирует график разряда цилиндрической батарейки Duracell MN1500 в корпусе АА.
График разряда щелочной батарейки Duracell MN1500 при температуре 210 С.
На графике видно, что при токе разряда 1 ампер батарейка может проработать 1 час до снижения напряжения до 0,9 вольт, а при токе разряда 0,25 ампер батарейка работает 9 часов. Существуют щелочные батарейки с намного большей емкостью.
- Duracell MN903 при напряжении 7,5 вольт работая на нагрузку 2,7 Ом, в начале разряда дает ток 2,7 ампера. Продолжительность работы при снижения напряжения до уровня в 3,5 вольта достигает 18 часов, а при начальном токе разряда 750 миллиампер на нагрузку 10 Ом батарейка может работать более семидесяти часов.
- Во время реакции электролит расходуется очень незначительно, поэтому его требуется меньше чем в солевой батарейке. При реакции не выделяются газы, что позволяет исключить из конструкции камеру для сбора газов. Эти особенности электрохимической реакции с участием щелочного электролита позволяют лучше использовать объем батарейки.
- Отрицательный электрод представляет собой цинковый порошок, занимающий 20-30 % объема, а не стакан как у солевой батарейки. Конструкция батарейки дает возможность значительно увеличить срок службы и повысить максимальный ток, отдаваемый в нагрузку.
Конструкция
Отрицательный электрод, расположенный в центральной части батарейки, представляет собой пасту из цинкового порошка, электролита и загустителя. Для предотвращения коррозии применяется цинк высокой чистоты, имеющий специальные добавки других металлов.
- Это позволило отказаться от применения ртути. Внутри порошка находится латунный стержень, выполняющий функцию токоотвода.
- Использование порошка позволяет значительно увеличит площадь соприкосновения электрода с электролитом, что снижает внутреннее сопротивление батарейки и увеличивает ток разряда.

- Удельная поверхность цинкового порошка составляет около 0,02 м2/г. Большой запас вещества отрицательного электрода позволяет значительно продлить срок службы батарейки.
- Отрицательный и положительный электроды разделены пористой мембраной, пропитанной электролитом. Мембрана исключает перемешивание паст положительного и отрицательного электродов.
Положительный электрод состоит из смеси оксида марганца и графита, заполняющей объем между мембраной и стальным герметичным корпусом батарейки.
В щелочной батарейке находится в полтора раза больше оксида марганца, чем в солевой батарейке.
Отсутствие выделения газов при электрохимической реакции в щелочной батарейке позволяет делать ее корпус герметичным.
В нижней части батарейки расположен защитный клапан, защищающий батарейку от взрыва. Если при прохождении химических процессов или из-за нагрева внутри будут накапливаться газы, то откроется защитный клапан и часть электролита выйдет наружу, герметичность будет нарушена.
- Батарейки и аккумуляторы выпускаются в одинаковых корпусах. Использование щелочных батарей и аккумуляторов может привести к попытке зарядить щелочную батарейку в стандартном зарядном устройстве.
- При заряде будет происходить накопление газов внутри батарейки и ее нагрев. Клапан предохраняет батарейку от взрыва при возрастающем давлении при экспериментах с зарядом.
Положительным полюсом является стальной стакан, являющийся корпусом батарейки, отрицательным полюсом является стальная тарелка, расположенная в нижней части корпуса и соединенная с латунным стержнем. Элементы конструкции положительного и отрицательного полюсов разделены изолирующей прокладкой.
Преимущества и недостатки
Благодаря особенностям конструкции щелочная батарейка имеет преимущества и недостатки. Главным преимуществом является увеличенный ток разряда.
- По сравнению с солевыми батарейками щелочные имеют значительно увеличенный срок службы благодаря большому запасу реагентов.

- Срок хранения также увеличился и может составлять несколько лет. После года хранения емкость снижается не более чем на 10 %.
- Батарейки хорошо работают в широком температурном диапазоне. При работе напряжение батарейки долгое время не изменяется и только в конце срока службы резко уменьшается.
- Щелочные батарейки дороже солевых, их вес больше из-за особенностей конструкции.
Способы восстановления солевых батареек неприменимы к щелочным батарейкам. Так как емкость щелочных элементов питания существенно превышает емкость солевых, то их необходимо использовать в устройствах со средним и высоким потреблением энергии. Это электробритвы, плееры, диктофоны, а также фотовспышки и мощные фонари.
Заряжаемые батареи
Существуют способы подзарядки щелочных батареек, продлевающие их срок службы, но производителями такие действия не рекомендуются, результат подзарядки может быть самым непредсказуемым.
Возможность небольшой зарядки щелочных батареек дает обратимость электрохимической реакции, протекающей при разряде, но конструкция не обеспечивает безопасную зарядку.
Поэтому были разработаны специальные перезаряжаемые щелочные батареи, получившие названия полуторавольтовые аккумуляторы, заряжаемые щелочные батарейки или RAM (Reusable Alkaline Manganese, Rechargeable Alkaline Manganese – многократно используемые щелочные марганцевые), исключающие утечку электролита или разгерметизацию которые могут произойти при многократной перезарядке.
- Патент на первое поколение таких батареек был получен в Канаде. Их выпуск был начат в конце восьмидесятых годов.
- К неоспоримым преимуществам следует отнести возможность приобретения химического источника питания готового к работе без предварительной зарядки. Если после приобретения аккумулятора его нужно вначале зарядить, а потом использовать, то заряжаемые батарейки можно сразу устанавливать бытовую технику, не имея под рукой зарядного устройства.

- Приобретая заряжаемую батарейку, мы получаем первичный источник тока. После первого разряда батарейку можно зарядить и она становится вторичным источником тока.
Таким образом, заряжаемые батарейки занимают промежуточное положение между первичными и вторичными источниками тока. Напряжение батарейки составляет 1,5 вольта и почти не меняется до полного разряда. Эти батарейки могут работать в режиме разрядных токов до 600 миллиампер.
Емкость батарейки габарита АА достигает 2 ампер-часа. Их внутренне сопротивление выше, чем внутреннее сопротивление обычных батареек. Активные вещества цинк и оксид марганца. Перезаряжаемые щелочные батарейки являются хорошей заменой никель-кадмиевых и никель-магниевых аккумуляторов.
В заряженном состоянии заряжаемые батарейки могут храниться несколько лет. Цена заряжаемых батареек в два раза выше цены обычных щелочных, но ниже цены аккумуляторов. Длительный срок хранения, превосходящий показатели никель-кадмиевых, никель-магниевых аккумуляторов, отсутствие вредных веществ позволяет заряжаемым щелочным батарейкам составить конкуренцию аккумуляторам, применяемым в бытовой технике.
Если батарейки разряжены менее чем на 25 %, то они могут перезаряжаться несколько сот раз до напряжения величиной 1,42 вольта, если они разряжены более чем на 25 % и менее чем на 50 %, то возможен перезаряд до 50 раз до напряжения уровнем 1,32 вольта.
Сильно разряженная батарейка может перезаряжаться не более 20 раз. Батарейки могут использоваться в любом устройстве, которое поддерживает стандартные габариты (AA, AAA, C, D, и другие). Батарейки этого типа более всего подходят для устройств с низким потреблением тока в дежурном режиме, которые используются периодически.
Например: пульты дистанционного управления, портативные радиостанции, карманные фонарики и другие. В некоторых странах заряжаемые батарейки получили широкое распространение.
Есть бытовые приборы, в которых они рекомендованы в инструкциях. Некоторые приборы, ориентированные на этот тип батареек оснащены блоком питания, обеспечивающим два варианта зарядки – аккумулятор или батарейка. Блок питания таких приборов, рассчитанных на габарит АА, поддерживает зарядный ток в диапазоне 10…20 миллиампер для исключения последствий из-за возможной путаницы между заряжаемыми батарейками и обычными.
Некоторые приборы, ориентированные на этот тип батареек оснащены блоком питания, обеспечивающим два варианта зарядки – аккумулятор или батарейка. Блок питания таких приборов, рассчитанных на габарит АА, поддерживает зарядный ток в диапазоне 10…20 миллиампер для исключения последствий из-за возможной путаницы между заряжаемыми батарейками и обычными.
При низких температурах эти батареи подходят только для маломощных устройств. Щелочные батарейки имеют множество преимуществ перед батарейками других типов. Это позволило им завоевать популярность во всем мире.
Отличия алкалиновых батарей от солевых
Батарейки алкалиновые — недорогие и надежные элементы питания, которые служат дольше солевых аналогов. Однако далеко не все знают о том, какие батарейки лучше и в чем разница между теми или иными типами элементов. Многие ошибочно полагают, что солевые и алкалиновые АКБ — это одно и то же. Для того чтобы не совершать подобных ошибок, нужно разобраться в вопросе подробнее.
Ключевое понятие в данном случае — это химический состав электролита в элементе. Если коротко, состав электролита у солевых батареек — это, разумеется, солевой раствор, а у алкалиновых — щелочь. Во избежание путаницы следует знать о том, что само понятие «батарейки alkaline» — не что иное, как именно щелочные (таков перевод английского слова).
- В качестве примера можно привести популярные солевые элементы, электролит которых состоит из хлорида цинка. Алкалиновые АКБ содержать в себе жидкость, в качестве которой применяется не солевой, а щелочной раствор (обычно это гидроксид калия).
- При взаимодействии с полюсами аккумулятора щелочь выделяет гораздо больше химической энергии, чем соль. Именно поэтому щелочные батарейки отличаются лучшей производительностью, и их ОКПД (общий коэффициент полезного действия) намного выше, чем у солевых аналогов.
- Многие считают, что наилучшие алкалиновые элементы — это Duracell, которые уже в течение долгого времени являются лидирами на рынке.

- Среди отечественных производителей неплохо показали себя батарейки «Космос», хотя российская алкалиновая АКБ отличается от мощной «дюраселки» более скромным показателем емкости и стоит намного дешевле.
Классификатор продукции, обычно, маркирует алкалиновые, солевые и литиевые элементы питания буквенными обозначениями, например, АА и ААА. В зависимости от размера, их можно использовать в фонариках, настенных часах, электронных игрушках, пультах для телевизоров и так далее. Можно сказать, что батарейки алкалиновые — лучшие после литиевых, от покупки которых потребителей часто удерживает цена.
Коротко различия между щелочными и солевыми батарейками можно обозначить в нескольких пунктах.
Характеристики солевых батареек:
- После 2-3 лет хранения они полностью разряжаются и больше непригодны к использованию.
- Неустойчивы к перепадам температуры, вследствие чего их емкость может быстро уменьшаться.
- Часто «протекают» по причине того, что ближе к концу разряда солевой раствор дает сильную химическую реакцию. Если планируется долгое время не пользоваться устройством, их нельзя надолго оставлять внутри него.
- Цена их минимальна: конечно, в этом есть и плюс, но и по времени работы они — далеко не лучший из возможных вариантов.
- Если, все же, их использовать, оптимально будет ограничиться устройствами с самым низким потреблением энергии (часы, весы, пульты дистанционного управления).
В свою очередь, алкалиновая «линейка» имеет следующие преимущества:
- Щелочные АКБ можно хранить к течение 3-5 лет, и их производительность будет хорошей, с минимальным разрядом.
- Для алкалиновых аккумуляторов характерна стойкость к температурным колебаниям.
- Они не протекают, их безопасно хранить внутри устройства, которое не используется.

- Существенное отличие в плане производительности: удельная емкость алкалиновой батарейки в полтора раза больше, чему у солевой, при минимальных нагрузках. Если же нагрузка максимальна, работоспособность щелочной АКБ превышает этот показатель у солевой в 4-10 раз.
- Самые высокие результаты работы щелочной аккумулятор будет показывать при условии равномерной нагрузки.
- Цена — средняя, выше, чем у солевых, но это себя оправдывает.
Полезное видео:
Тестирование
Многие спрашивают о том, какие батарейки лучше, потому что в многочисленных фирмах-производителях бывает легко запутаться, а постоянно покупать тот же Duracell может позволить себе не каждый. Поскольку очень часто батарейки типа АА и ААА применяются в детских игрушках, неудивительно, что и дети, и родители очень хотят, чтобы пушистый механический друг работал гораздо дольше.
Как уже было сказано, среди отечественных аналогов алкалиновых элементов в плане показателей емкости неплохим вариантом является «Космос». В России существует несколько компаний, которые проводят батарейкам специальный тест и на основании его показателей помогают людям выбрать лучший из недорогих отечественных вариантов.
Одной из таких компаний является «Источник». Для того чтобы тест аккумулятора на работоспособность был правдивым и точным, в качестве «подопытных» были взяты шесть приборов, напоминающие детские игрушки.
Они были поставлены в интенсивные рабочие условия, с максимальным потреблением энергии от батареек. Тест показал, что сила разрядного тока составила около 1000 миллиампер.
- Разные батарейки алкалинового типа подвергались такому разряду вплоть до падения уровня напряжения в 0,9 вольт.
 Все показатели фиксировались в специальной таблице.
Все показатели фиксировались в специальной таблице. - Главным «мерилом» эффективности была емкость каждого элемента, оставшаяся после испытаний.
- Среди восьми батареек разных производителей в эксперименте участвовали марки «Фотон» и «Космос», емкость которых даже после серьезных испытаний оставалась на приличном уровне.
- Таким образом, если есть желание приобрести недорогие алкалиновые элементы, которые обладают неплохой производительностью, можно спрашивать в магазинах именно эти марки.
Тестирование доказало, что эти варианты являются очень удобными и выгодными в том случае, когда нет возможности приобрести литиевые или более дорогие алкалиновые батарейки.
Можно ли заряжать щелочные?
Многие спрашивают о том, можно ли заряжать алкалиновые батарейки, «раскачав» их с помощью тех или иных показателей тока, чтобы они могли дольше работать, не уменьшая своей производительности.
Если подходить к делу с максимальной «строгостью», обычные батарейки даже не принято называть аккумуляторами, поскольку повторной зарядке они не подлежат, и она рискует закончиться плачевно: перегрев, утечка электролита, а если кому-то взбредет в голову подзарядить литиевые элементы «экстремальными» токами — в некоторых случаях может произойти и взрыв, так как литий является наиболее опасным веществом.
- Следует иметь в виду то, что существуют как перезаряжаемые, так и неперезаряжаемые элементы питания. На корпусе батареи всегда есть обозначение о том, перезаряжаемая она или нет.
- Если элемент импортный, на нем можно найти английское слово rechargeable, что в переводе означает «перезаряжаемый».
- В случае, когда приходится иметь дело с обычными недорогими батарейками, чаще всего на них можно увидеть надпись do not recharge («не перезаряжать»).
Однако в народе всегда находятся смельчаки и умельцы, которые, невзирая на потенциальную опасность, могут «реанимировать» элементы со слабым уровнем емкости. В этом случае не лишним будет все же напомнить о том, что литиевые батарейки не стоит подвергать такому эксперименту: «тест» может быть небезопасным для смельчака. По идее, обыкновенные АКБ не предназначены для подзарядок, и любой электролит может либо вытечь или взорваться.
По идее, обыкновенные АКБ не предназначены для подзарядок, и любой электролит может либо вытечь или взорваться.
Можно ли зарядить их — в принципе, да, но после такой «реанимации» они не будут работать долго.
Как это сделать
Перед тем как зарядить батарейку в домашних условиях, следует принять к сведению несколько простых советов:
- Не рекомендуется вскрывать элемент.
- Нельзя его разбирать.
- Не стоит делать надрезы на корпусе, стучать по элементу.
Такая техника безопасности поможет не только уберечь себя от возможных неприятных последствий, но и будет способствовать тому, чтобы зарядка алкалиновых батареек прошла успешно, и они смогли выработать свой остаточный потенциал.
Для «реанимации» потребуются:
- Сам щелочной элемент питания, нуждающийся в экстренной подзарядке.
- Зарядное устройство с показателем постоянного тока от 9 до 12 вольт.
- Провода — для того, чтобы правильно собрать простую схему.
- Мультиметр, с помощью которого будет проводиться тест напряжения.
- Желательно наличие термопары или термометра для измерения температуры элементов.
Алкалиновые батарейки можно заряжать, но с условием соблюдения техники безопасности и знанием основ сборки простой электронной схемы. Для начала следует понять, какой у них уровень остаточного заряда. Будет достаточно вставить их в то устройство, которое используется, и замерить показатели с помощью мультиметра или вольтметра. Затем можно приступить к самому процессу «реанимации», памятуя о том, что любая ошибка может быть чревата неприятными последствиями:
- Оголяем у зарядного устройства контакты.
- Подключаем его к розетке.
- Присоединяем к контактам «зарядника» батарейку с помощью соединительных проводов, строго соблюдая полярность (минус к минусу, а плюс — к плюсу).

- Далее батарейка начнет нагреваться, внимательно контролируем этот процесс с помощью термопары.
- По достижении температуры в 50°С отключаем цепь.
- Ждем две минуты до остывания батарейки.
- Снова замыкаем цепь включением «зарядника» в розетку.
- Следим за температурой.
Такую манипуляцию следует проводить в течение пяти минут, затем вставить элемент питания обратно в устройство и проверить его работу. Лучшим «тестером» может стать обычный карманный фонарик. Если он будет светить ярко, значит, подзарядка прошла успешно.
Теперь подзаряжаем батарейку так называемым «шоковым» способом:
- Подключаем ее обратно в цепь.
- Коротко включаем «зарядник» в розетку и тут же вынимаем его.
- Так сделать нужно несколько раз, в течение полутора-двух минут.
- Замеряем показатели напряжения (они могут быть выше прежних).
- После всех «мучений» народные умельцы рекомендуют охладить батарейки в морозильнике, затем, после извлечения оттуда, довести их до комнатной температуры и вставить в устройство.
Если зарядить алкалиновые батарейки таким способом, это поможет ненадолго продлить им жизнь. Безусловно, метод может оказаться и полезным — в случае, если у вас нет подходящего зарядного устройства для батареек.
Но лучше всего приобрести новые элементы и всегда держать их поблизости в качестве запасных. Тем более, щелочные батарейки хранятся долго, не теряя своей работоспособности.
Что из себя представляет?
Сегодняшнюю жизнь в мире высоких технологий сложно представить без такой простой вещи, как батарейка. Маленькое приспособление, которое способно давать ток и позволяет пользоваться многими предметами быта. А тем временем, батарейке уже больше 200 лет. Еще в 19 веке итальянский ученый Вольта изобрел первый элемент, состоящий из анода, катода и солевого электролита.
А тем временем, батарейке уже больше 200 лет. Еще в 19 веке итальянский ученый Вольта изобрел первый элемент, состоящий из анода, катода и солевого электролита.
Его именем и стала называться единица измерения напряжения электрического тока. Конечно, в те времена батарейка выглядела иначе, была громоздкой и мало где могла примениться. До наших дней она прошла большой путь и значительно видоизменилась. Кроме того, все батарейки подразделились на 2 подвида: солевые и алкалиновые (щелочные).
солевые элементы
Устройство солевой батарейки чрезвычайно простое. Она состоит из цинкового катода, анода – двуокись марганца и электролита – хлорид аммония. Отсюда происходит само название солевая батарейка, поскольку в качестве электролита выступает соль.
Между реагентами расположена специальная прокладка, благодаря ей ингредиенты не смешиваются, но она пропускает электролит. Между электролитом и химическими элементами анода и катода возникает реакция и выделяется электрический ток.
После того как ток образовался, он переходит на токосниматели, которые расположены внутри батарейки, а затем на раздельные электроды с разных концов батарейки и в итоге передается электронному устройству.
Напряжение в такой батарейке равно 1,5 В. Стандартные размеры АА (пальчиковая) и ААА (мизинчиковая).
Кроме стандартных размеров, которые встречаются наиболее часто, используются батарейки следующего типа:
- С или LR 14 (похожа на маленький бочонок).
- D или LR 20 (большой бочонок).
- 6F22 «крона» (прямоугольная батарейка чуть меньше спичечного коробка).
Преимущества солевой батарейки:
- Маленький вес.
- Дешевизна.
- Возможно продлить срок службы если дать батарейке «отдохнуть».
Недостатки:
- Низкие энергетические показатели.
- Плохо работают при низких температурах.
- Небольшой срок хранения.
- Быстрый саморазряд.

- Плохая герметичность, окисление оболочки.
Солевые батарейки обладают интересной способностью работать еще некоторое время, после того как, казалось бы, уже не могут. Дело в том, что если вытащить батарейку из устройства, к тому же немного потрясти ее или немножко постучать по ней, то можно выровнять комки электролита, который находится внутри и использовать его до конца.
Эти недорогие батарейки с небольшой мощностью подходят для приборов, не требующих высокого токопотребления, например:
- Детские игрушки.
- Небольшие фонарики.
- Пульты телевизоров.
- Часы.
- Радиоприемники.
Лидерами в производстве солевых батареек в России являются компании Космос, Энергия, Фотон. Среди мировых производителей на первом месте Sanyo и GP.
Что такое алкалиновая батарейка
Алкалиновая батарейка также состоит из анода – порошкообразный цинк, катода – диоксид марганца и электролита, в качестве которого выступает гидроксид калия, который является щелочью. Следовательно, отсюда идет название и самих батареек. Алкалиновыми батарейки стали называть только потому, что на английский язык щелочь переводится как Alkaline, и на многих батарейках зарубежного производства есть эта надпись.
Принцип работы у алкалиновых батареек такой же, как и у солевых. Химические элементы анода и катода аналогично взаимодействуют посредством электролита, а вырабатываемый ток передается устройствам через токоотводы.
Появились такие батарейки в 1959 году благодаря изысканиям и научным разработкам Льюиса Урри. Напряжение 1,5 В. Стандартные размеры батареек АА и ААА, LR 14, LR 20, 6F22.
Преимущества алкалиновой батарейки:
- Большая емкость.

- Хорошо работают при средних нагрузках.
- Могут работать при низких температурах.
- Надежная герметизация.
- Низкий показатель саморазряда.
- Срок хранения до 7 лет.
Недостатки:
- Высокая цена.
- Более тяжелые.
- Когда ресурс выработан, мгновенно «умирают».
Алкалиновые батарейки применяются там, где нужно среднее и высокое токопотребление, например:
- Мощные фонари.
- Аудиоплееры.
- Диктофоны.
- Фотоаппараты и фотокамеры.
- Пульты от сигнализации.
Пальма первенства среди фирм производителей таких батареек принадлежит американским компаниям Duracell и Energizer, за ними следуют японские Sony и Toshiba.
Что общего у солевых и алкалиновых батареек
- Имеют одинаковый стандартный размер.
- Могут быть использованы в одних и тех же устройствах (но солевые выйдут из строя очень быстро).
- Одинаковое напряжение.
- И те и другие батарейки нельзя подзаряжать, это может привести к их взрыву.
- Оба типа батареек, после использования необходимо правильно утилизировать.
Сегодня все больше стран уделяют внимание утилизации солевых и алкалиновых батареек. Большинство развитых государств создают специальные пункты приема, куда можно отнести использованные элементы, а при покупке новых даже получить скидку.
Батарейки отправляются на специальные заводы, где из них извлекают опасные металлы и химические соединения, для вторичной переработки. Если этого не делать, токсичные вещества могут попасть в землю, воду, а при сжигании мусора и в воздух, а это чревато, в свою очередь, серьезными последствиями для всех живых организмов на планете.
Чем отличаются
- Емкость щелочных батареек в 2-4 раза больше чем у солевых.
- Срок службы солевых батареек в 5 раз меньше алкалиновых.

- Алкалиновые батарейки в отличие от солевых могут работать в экстремальных температурных условиях.
Ежегодно в мире продается и используется примерно 11 миллиардов батареек. Многие компании, выпускавшие ранее смешанные типы батареек, сворачивают производство солевых. Считается, что их использование в скором времени будет не целесообразно, поскольку прогресс шагает вперед, и технике требуются более мощные аккумуляторы.
Что из себя представляет?
Когда устройство, работающее на батарейках, имеет значительную мощность, то возникает необходимость в приобретении элементов питания, которые способны обеспечивать прибор необходимым током, в течение длительного времени. Алкалиновые батарейки хорошо справляются с этой задачей, поэтому, несмотря на более высокую стоимость, они пользуются большой популярностью у покупателей.
Щелочной или алкалиновый(alkaline переводится с английского, как щелочь) источник питания представляет собой элемент, в котором в качестве катода применяется диоксид марганца, а анодную функцию выполняет цинковый порошок. В качестве электролита в составе этого типа батарей используется раствор гидроксида калия, который является щёлочью, что и отразилось на названии этого типа элементов питания.
Щелочные батареи могут выпускаться различных типоразмеров. Величина разности потенциалов на выводах также может существенно отличаться, поэтому прежде чем приобретать элемент питания необходимо правильно подобрать тип алкалиновой батареи.
Разновидности и типоразмеры
Прежде всего щелочные батарейки различаются по типу корпуса. В основном на прилавках магазинов представлены щелочные изделия следующих типов:
- Таблетки (монетки). Этот тип щелочных элементов питания представляет собой диск, диаметр которого может быть от 4,8 до 30 мм.
Изделие имеет металлический корпус, поэтому могут быть успешно использованы в устройствах, работающих в неблагоприятных условиях. Компактность – основное преимущество этого типоразмера щелочных батарей, поэтому наиболее часто их устанавливают в наручные часы, брелоки сигнализаций и слуховые аппараты.
Компактность – основное преимущество этого типоразмера щелочных батарей, поэтому наиболее часто их устанавливают в наручные часы, брелоки сигнализаций и слуховые аппараты.
- Мизинчиковые батарейки (AAA). Мизинчиковые батарейки представляют собой цилиндр, диаметр которого равен 10,5 мм. Длина изделия – 44,5 мм, а вес — около 14 г.
Щелочные батарейки этого типа имеют на корпусе обозначение alkaline battery ААА, поэтому их несложно будет отличить от солевых или литиевых. Применяют мизинчиковые батарейки в фонариках, игрушках, радиоприёмниках и пультах дистанционного управления.
- Пальчиковые батарейки (АА). Эта категория алкалиновых батареек является самой распространённой. Используются пальчиковые батарейки в часах, радиоприёмниках, фонариках, детских игрушках, пультах ДУ и других устройствах, где необходим значительный ток разряда при минимальных размерах элемента питания. Наиболее часто щелочные изделия этого типа выпускаются с напряжением 1,5 вольта.
- Крона. Щелочная батарейка типа «Крона» представляет собой элемент питания, напряжение которого на выводах составляет 9v. Достоинства этого типа заключается в том, что при относительно небольших габаритах изделие позволяет обеспечить прибор повышенным напряжением. Элемент используется в пультах ДУ, электроизмерительных приборах, детских игрушках.
- Бочонки. Большие бочонки позволяют обеспечить электроэнергией приборы, потребляющие большой ток, без подключения их к электрической сети. Наиболее часто элементы питания этого типа применяются в музыкальных проигрывателях, детских игрушках, фонариках.
Отличить щелочную батарейку от солевой совсем несложно. На корпусе изделия должна быть маркировка LR, которая указывает на наличие щелочного электролита внутри корпуса.
Какие лучше
Щелочные батарейки лучше солевых изделий по многим параметрам. Прежде всего, изделия этого типа предпочитают обычным батарейкам по причине значительно большей ёмкости. Разница в продолжительности работы элементов может достигать более 5 раз.
Разница в продолжительности работы элементов может достигать более 5 раз.
Если необходимо использовать электрическое устройство на морозе, то в этом случае также необходимо устанавливать в прибор алкалиновые батарейки, которые эффективно работают при температуре до — 20 градусов. Солевые батарейки становятся неработоспособными при любой отрицательной температуре.
Во время сильного разряда из корпуса солевой батарейки может вытечь электролит, что может привести к порче электрического устройства. Щелочные элементы практически лишены такого недостатка.
Преимущества и недостатки
Среди преимуществ щелочных источников питания можно назвать следующие:
- Низкий саморазряд.
- Возможность работы при отрицательной температуре воздуха.
- Продолжительный срок годности.
- Хорошо переносят относительно большие токи разряда.
- Равномерный разряд батареи.
К недостаткам этого типа батарей относятся:
- Относительно большой вес изделия.
- Высокая стоимость.
Значительно более высокая цена изделия компенсируется продолжительным периодом эксплуатации. К недостаткам таких изделий можно также невозможность использовать его повторно.
Можно ли заряжать
Если щелочная батарейка разрядилась, то её необходимо утилизировать. Не следует пытаться восстановить элемент питания с помощью зарядного устройства. Подобные действия могут привести к разгерметизации корпуса батареи. Разрыв изделия может привести к травмам или возгоранию, поэтому категорически запрещается заряжать алкалиновые батарейки.
Популярные производители
Гарантировано приобрести качественную продукцию можно только в том случае, если покупать щелочные батарейки известных производителей. На сегодняшний день наибольшим спросом пользуются маргацево щелочные элементы следующих производителей:
- Energizer – достоинство алкалиновых элементов питания от известного американского производителя электротехники заключается в том, что изделие позволяет поддерживать необходимое напряжение в устройстве, на протяжении всего времени эксплуатации изделия.

- Duracell – щелочные элементы питания этой фирмы обладают минимальным саморазрядом и максимальной ёмкостью при стандартных размерах.
- Рanasonic – батареи этого производителя отличаются стабильной отдачей электроэнергии, а также повышенной ёмкостью и устойчивостью работы при отрицательной температуре воздуха.
- Сamelion – щелочные изделия этой фирмы производятся в Китае, но качество изделий очень достойное. Батареи Сamelion хорошо переносят глубокий разряд, и сохраняют номинальное напряжение в течение всего срока эксплуатации.
Многие производители щелочных батарей поставляют на рынок качественные изделия, поэтому можно смело приобретать элементы питания таких фирм, как gp,
smartbuy, космос, varta и др. Важно при покупке не нарваться на подделку, поэтому покупать батарейки следует только в проверенных торговых точках.
Источник: https://istochnikipitaniy.ru/batarejki/alkalinovye-shhelochnye.html
Литиевые, алкалиновые и солевые батарейки, никелевые аккумуляторы
Вопрос выбора элементов питания поднимался пользователями не раз. Для раций, для различных вспомогательных устройств, в блоках дополнительного питания и т.д. По заданию редакции adne.info я проведу небольшой экскурс и мы попытаемся выяснить что лучше. Причём это не исчерпывающий опус, скорее тезисные отметки по тем или иным моментам.
Сразу — про солевые элементы забываем. Да, они дёшевы, но текут, разряжаются на морозе с ними тоже проблемы. Их назначение — телевизионные пульты.
Алкалиновые — щелочные батарейки, имеют особенность: если батарейка села, даём ей минут 30 отдохнуть и она снова проработает некоторое время. Поэтому есть способ продлить их службу: периодически меняя 2 комплекта.
Литиевые батарейки нельзя заряжать. При зарядке они могут взорваться! Работают в 7 раз дольше алкалиновых, могут не терять заряда годами.
Из одного комментария: я спасатель, для нас хорошие батарейки это не только эффективность работы, но, зачастую и собственное выживание.
Навигатор, фонарь — всё это должно работать без проблем.
При минусовых температурах электролит загустевает. Здесь нужны только литиевые элементы.
Хранить и батареи и аккумуляторы надо отдельно от устройств.
Есть обычные батарейки, что для розничной продажи, и есть те что для промышленного потребления, у них и упаковка другая и оформление самого элемента отлично, а самое главное они и живут дольше, и это не субъективное мнение, а реально замеренные данные на примере использования. Разницу я бы оценил от 1,5 до 2,5 раз дольше. Проверяли (использовали) на рациях. 12 комплектов (24 рации), половина с батарейками купленными в супермаркете, те же дурасел, срок годности в норме, вторая половина с теми что я купил. Супермаркетовские выдержали примерно 8 часов работы (1 смена), второй день работали только промвариант, отработали еще почти смену.
Батареи повышенной емкости Energizer и Duracell можно использовать для основных приборов, помня, что емкость у них не слишком большая и при значительном потреблении тока разряжаются быстро.
Батареи высокой плотности заряда и длительного срока хранения — Energizer L91-2 (LR6) Ultimate Lithium, Size «AA», 1.5V, Li-Fe — поколение батарей, основанных на Li-Fe технологии с высокой емкостью (даже больше, чем у аккумуляторов) и длительным сроком хранения (несколько лет). Единственный их недостаток — цена, сравнимая со стоимостью аккумуляторов.
Никелевые аккумуляторы:
- Никель-кадмиевые: перед зарядкой обязательно максимально разряжайте, иначе ёмкость будет постепенно уменьшаться.
- Никель-металлгидридные: в 3 раза более ёмкие чем кадмиевые.
Для долгой и периодической работы советую аккумуляторы с низким саморазрядом (Sanyo eneloop 2000 mAh, Varta long life Ready2Use 2100 mAh или аналогичные) как основной источник тока для приборов. В довесок комплект из батарей повышенной емкости Energizer Ultimate Lithium в запаянном полиэтиленовом пакете.
Частный инвестор с 2006 года (акции, недвижимость). Владелец бизнеса, специалист по интернет маркетингу.
Литиевые, щелочные, серебряные и другие батареи (элементы) — какие виды и типы батарей?
Разработчиком «батарей» (как их обычно называют, хотя и ошибочно), которые до сих пор используются, является французский инженер Жорж Лекланше, который построил свой элемент . (как его правильно называть) в 1866 году. Однако не следует путать элемент с аккумуляторными батареями, которые доступны в тех же размерах, но их принцип действия отличается (разница между батареями и аккумуляторными батареями будет объяснено в конце этого текста).Поскольку потребность — мать изобретения, оригинальный элемент Leclanché с номинальным напряжением около 1,5 В использовался для питания телеграфов, звонков и первых телефонов. Сегодня, по прошествии более 150 лет, такие батареи используются для питания небольшого электрического оборудования, например игрушек, радиоприемников, аудиоплееров, фонариков и прочего. Кроме того, в обычном оборудовании все чаще используются более дорогие элементы на основе лития.
Разнообразие силового оборудования предъявляет различные требования к элементам с точки зрения емкости, напряжения или тока короткого замыкания.Это отражается в их размерах и форме, а также в конструкции и типе используемого электрода или электролитического материала. В чем разница между «батарейками» и как их правильно использовать?
Цинк-угольные элементы
Недостатком оригинальной ячейки Лекланше было использование жидкого электролита. Он состоял из сосуда, в котором помещались цинковый электрод и контейнер из пористого материала. В этот контейнер насыпали влажный порошкообразный диоксид марганца, смешанный с угольной пылью, и поместили в него угольный стержень. Внешний контейнер был заполнен концентрированным раствором хлорида аммония. Диоксид марганца действует как так называемый деполяризатор угольного электрода, поглощая водород. В противном случае газ, скопившийся на поверхности углеродного стержня, изолировал бы его от остального электролита и прервал бы ток.
Внешний контейнер был заполнен концентрированным раствором хлорида аммония. Диоксид марганца действует как так называемый деполяризатор угольного электрода, поглощая водород. В противном случае газ, скопившийся на поверхности углеродного стержня, изолировал бы его от остального электролита и прервал бы ток.
На удобство использования этого типа блока питания большое влияние оказала конструкция «сухой» версии элемента. Это было сделано в Германии в 1887 году Карлом Гасснером. Он заменил жидкий раствор хлорида аммония смесью этой соли и влажной гипсовой пыли (сейчас обычно используют крахмальный клей или силикагель).
За более чем 150 лет своего развития элемент Leclanché (широко известный как цинковая батарея) претерпел множество модификаций, направленных на повышение его долговечности и емкости. Один из способов продлить время работы — добавить хлорид цинка в пасту для наполнения стаканов — такие элементы называются Heavy Duty и предназначены для питания более требовательных устройств. Обратите внимание, что хлорид аммония представляет собой соль слабой щелочи и сильной кислоты, поэтому он гидролизуется и образует кислотный раствор, который заполняет ячейку.В такой среде цинк постоянно растворяется, даже если из системы не поступает электричество. Чтобы противодействовать этому явлению, используются различные методы, позволяющие свести к минимуму использование металла в состоянии покоя аккумулятора. Один из них — амальгамирование, то есть покрытие внутренней поверхности цинковой чашки ртутью. Ртуть образует раствор с цинком, и амальгама цинка практически не реагирует с кислотами, но сохраняет все электрохимические свойства чистого металла. Из-за защиты окружающей среды этот способ увеличения срока службы элементов используется все реже (элементы, не содержащие ртути, имеют маркировку «0% ртути» или «без ртути»).Современные угольно-цинковые батареи имеют теоретическую плотность энергии от 40 до 70 Втч / кг. Диапазон рабочих температур -10 . .. + 50 ° C. Срок службы угольно-цинковых аккумуляторов составляет около 2 лет.
.. + 50 ° C. Срок службы угольно-цинковых аккумуляторов составляет около 2 лет.
Ознакомьтесь с самыми популярными цинковыми элементами, доступными на TME!
«Протекающие батареи»
При использовании угольно-цинковых элементов не оставляйте их в устройстве после разрядки аккумулятора из-за возможности утечки электролита. Это вызывает коррозию и может привести к повреждению оборудования.
Щелочные батареи Energizer
Вехой в области производства одноразовых батарей стал 1955 год и создание щелочной батареи. Это было сделано канадским инженером Льюисом Фредериком Урри, сотрудником компании, которая сегодня известна как Energizer. В его ячейке нет угольного катода и цинковой чашки. Оба электрода влажные, разделенные пастой. Смесь диоксида марганца и углерода действует как катод, а анод состоит из цинковой пыли, смешанной с гидроксидом калия.Обе смеси дополнительно дополнены загустителями. Металл используется только для полюсных выводов.
Щелочные элементы характеризуются гораздо лучшими характеристиками и, что наиболее важно, более высокой допустимой нагрузкой по току и повышенной долговечностью. Они также имеют более высокую плотность энергии, которая теоретически составляет от 80 до 100 Втч / кг, и более широкий диапазон рабочих температур от -30 до + 70 ° C. Срок службы таких аккумуляторов от 5 до 7 лет. Щелочные элементы обозначаются буквой L, например, стандартный элемент R6 (обычно известный как «пенлитовая» батарея) в щелочной версии обозначается LR6.
Узнайте о самых популярных щелочных элементах, доступных в TME!
Литий-марганцевые батареи
Литиевые батареи, например Литиевые батареи AA — это, по сути, литиево-марганцевые батареи. Их номинальное напряжение 3 В. Они устойчивы к температурным колебаниям и имеют высокую удельную энергию — до 270 Втч / кг. Это означает, что литиевые батареи AA хранят почти в три раза больше энергии, чем эквивалентные щелочные батареи AA . Они используются, например, в бытовой технике — часах, видеокамерах, фотоаппаратах, а также компьютерах. Они хранят энергию еще дольше, до 10 лет.
Они используются, например, в бытовой технике — часах, видеокамерах, фотоаппаратах, а также компьютерах. Они хранят энергию еще дольше, до 10 лет.
Семейство литиевых батарей включает множество подтипов, общим знаменателем которых является использование лития или его соединений в качестве анода. Соединения, используемые в качестве катодного материала, включают оксид марганца, тионилхлорид, оксид серы, йод, хромат серебра и другие. Эти типы батарей могут выдавать напряжение от 1,5 В до 3 В.7 В — в зависимости от используемых химикатов.
Литий-марганцевые батареиимеют чрезвычайно долгое время работы, поэтому их часто используют для питания устройств, требующих длительного срока службы, таких как кардиостимуляторы, слуховые имплантаты, часы, питание памяти конфигурации в электронном оборудовании и т. Д. сильноточный разряд и широкий диапазон рабочих температур (даже от -40 до + 65 ° C).
В прошлом батареи этого типа были очень дорогими и поэтому использовались редко.Сегодня, помимо оборудования, требующего длительного срока службы, они используются даже в некоторых игрушках. Одним из самых популярных типов литиевых батарей являются так называемые кнопочные элементы , широко известные как «плоские батареи на 3 В». Своим названием они обязаны своему кнопочному виду и небольшим размерам. Другие типы этих батарей также доступны на рынке, но из-за их относительно высокой цены по сравнению с щелочными батареями они используются реже.
Батареи, изготовленные на основе этого типа ячеек, из-за их высокой прочности, часто имеют приварные клеммы, позволяющие припаять батарею к плате.На практике, если мы используем такую батарею для питания статической памяти CMOS RAM или системы часов реального времени, мы можем наслаждаться несколькими годами службы без необходимости замены источника питания.
Посмотрите самые популярные литиевые элементы, доступные на TME!
Серебряные батарейки
Номинальное напряжение серебряных элементов составляет 1,55 В. Катод этого элемента изготовлен из оксида серебра, а анод — из цинка. Электролит — раствор гидроксида калия. Серебряные батареи были изобретены в конце XIX века, но их массовое производство началось только в 1960-х годах.Их часто называют серебряно-оксидными или серебряно-цинковыми батареями.
Катод этого элемента изготовлен из оксида серебра, а анод — из цинка. Электролит — раствор гидроксида калия. Серебряные батареи были изобретены в конце XIX века, но их массовое производство началось только в 1960-х годах.Их часто называют серебряно-оксидными или серебряно-цинковыми батареями.
Серебряные батареи характеризуются стабильным выходным напряжением и плоскими характеристиками разряда. Напряжение на выводах элемента очень быстро падает при его разряде. Теоретическая плотность энергии составляет 130 … 150 Втч / кг. Серебряные батареи предназначены для использования в устройствах, чувствительных к колебаниям напряжения и требующих стабильного источника питания, например измерительные приборы.
Срок службы серебряной батареи составляет примерно 2 года.Его основные недостатки включают тот факт, что цинк подвержен коррозии в щелочном электролите, что вызывает разрушение батареи. Поэтому следует учитывать, что чаще всего примерно через 5 лет они начинают протекать, и тем самым представляют угрозу для окружающей среды.
Посмотрите самые популярные серебряные элементы, доступные в TME!
Обозначения и размеры популярных аккумуляторов
Ниже вы найдете наиболее популярные обозначения и размеры аккумуляторов, представленные на рынке:
Батарейки АА (двойные А, батарейки пенлит)
Батарейки типа «AA» , обычно называемые «пенлитовые батарейки» , в качестве альтернативы обозначаются как R6 в стандартной версии и как LR6 в щелочной версии.Батарейка «AA» имеет диаметр 14 мм и высоту 50 мм. Его номинальное напряжение составляет 1,5 В. Предлагаемые в настоящее время батареи типа «AA» имеют емкость от 1600 до примерно 2500 мАч.
Батарейки AAA (батарейки Triple-A)
Батарейки «AAA», уменьшенная версия батареек Penlite, не менее популярны и имеют обозначение R03 в обычной версии и LR03 в щелочной версии. У них такое же напряжение, как у батареек типа «АА». Батарейка «AAA» имеет диаметр 10 мм и высоту 44 мм.У них также меньшая емкость — от 800 мАч примерно до 1200 мАч.
Батарейка «AAA» имеет диаметр 10 мм и высоту 44 мм.У них также меньшая емкость — от 800 мАч примерно до 1200 мАч.
LR61, R14, R20 и другие батареи
Еще одна разновидность пенлитовых батарей еще меньшего размера — щелочные батареи LR61. Их размеры составляют 8,3 мм в диаметре и 42,5 мм в высоту. Их номинальное напряжение составляет 1,5 В, а емкость достигает 650 мАч. Если требуется большая емкость, используйте цилиндрические батареи с маркировкой R14 или больше — R20.Размеры батарей R14 составляют 23 мм в диаметре и 50 мм в высоту. Их емкость может достигать 8000 мАч. Самый большой из популярных цилиндрических аккумуляторов — R20. Размеры батарей R20 составляют 33 мм в диаметре и 58 мм в высоту. Их емкость до 21000 мАч.
Батареи с напряжением, отличным от 1,5 В, производятся путем последовательного соединения ячеек. Например, так называемая плоская батарея состоит из 3 последовательно соединенных элементов R10. Другие, такие как популярная батарея 6F22 на 9 В, содержат шесть последовательно соединенных ячеек F22 размером 25 мм × 15 мм × 8 мм, заключенных в единый кубический корпус.
Указанную выше емкость аккумуляторов следует рассматривать как ориентировочную, потому что из-за постоянного технического прогресса и огромного спроса на эффективные источники энергии эти продукты постоянно развиваются, а их параметры меняются. Размеры и обозначения типов популярных угольно-цинковых и щелочных батарей приведены в таблице ниже.
| Обозначение батареи | Размеры батареи | Номинальное напряжение аккумулятора | |||
|---|---|---|---|---|---|
| ANSI | МЭК | NEDA | Прочие | [мм] | [В] |
| N | R1 | 910A | – | L = 30. 2 мм; D = 12 мм 2 мм; D = 12 мм | 1,5 В |
| AAAA | LR61 | 25А | MN2500 | L = 42 мм; D = 8 мм | 1,5 В |
| AAA | R03 | 24A | MN2400, AM4, UM4, HP16 | L = 44,5 мм; D = 10,5 мм | 1,5 В |
| AAAL | – | – | – | L = 50 мм; D = 10,5 мм | 1,5 В |
| AA | R6 | 15A | МН1500, АМ3, УМ3, HP7 | L = 50 мм; D = 14.2 мм | 1,5 В |
| – | R10 | – | – | L = 34 мм; D = 21 мм | 1,5 В |
| – | 2R10 | – | – | L = 68 мм; D = 21 мм | 3 В |
| С | R14 | 14A | УМ2, МН1400, ХП11 | L = 50 мм; D = 23 мм | 1,5 В |
| D | R20 | 13A | МН1300, УМ1, HP2 | L = 58 мм; D = 33 мм | 1.5 В |
| Ф | – | – | – | L = 87 мм; D = 32 мм | 1,5 В |
| Дж | – | – | – | L = 150 мм; D = 2 мм | 1,5 В |
| – | 3R12 | – | GP312S, плоский аккумулятор | Кубоид 67 мм × 22 мм × 67 мм | 4,5 В |
| – | – | – | фонарь, 996 | Кубоид 68 мм × 115 мм × 68 мм | 6 В |
| PP3 | 6LR61, 6F22, 6R61 | 1604A | МН1604, блок | Кубоид 48 мм × 25 мм × 15 мм | 9 В |
| – | 6F25 | – | – | Кубоид 48 мм × 25 мм × 25 мм | 9 В |
| PP9 | 6F100 | 1603 | – | Кубоид 51.6 мм × 65,1 мм × 80,2 мм | 9 В |
| – | 4R25X | 908 | MN908 | Кубоид 110 мм × 67,7 мм × 67,7 мм | 6 В |
| – | 4R25 | 915A | – | Кубоид 110 мм × 67,7 мм × 67,7 мм | 6 В |
| – | 4LR25-2 | 918A | MN918 | Кубоид 127 мм × 136,5 мм × 73 мм | 6 В |
| – | – | – | PC926 | Кубоид 127 мм × 136,5 мм × 73 мм | 12 В |
Обозначения литиевых кнопочных элементов не требуют заучивания их параметров наизусть, так как все они имеют номинальное напряжение 3 В, а размеры кодируются в обозначении батареи следующим образом: CR <2 цифр, диаметр в мм> <2 цифр , толщина - значение × 0. 1 мм>. Например, цифры, содержащиеся в символе популярной батареи CR2032, означают диаметр 20 мм и толщину 3,2 мм.
1 мм>. Например, цифры, содержащиеся в символе популярной батареи CR2032, означают диаметр 20 мм и толщину 3,2 мм.
К сожалению, приведенное выше утверждение относится только к обычным типам литий-марганцевых батарей с номинальным напряжением 3 В. Среди кнопочных элементов есть также серебряные батареи, которые имеют другую маркировку.
В чем разница между батареями и аккумуляторными батареями?
Короче говоря, аккумулятор — это одноразовый элемент, который становится бесполезным, когда запасенное в нем электричество истощается, потому что его нельзя перезарядить (т.е. мощность не может быть снова накоплена). Их противоположность — аккумуляторные батареи, то есть элементы со сроком службы от нескольких сотен до нескольких тысяч циклов зарядки и разрядки.
Краткое изложение наиболее важной информации об аккумуляторах
В этой небольшой статье описаны только самые популярные типы угольно-цинковых, щелочных и литий-марганцевых батарей. Невозможно суммировать 150 лет развития технологий и экспериментов с различными веществами.Поэтому в нем отсутствуют практически устаревшие ртутные батареи, которые выводятся из эксплуатации из-за содержания в них веществ, опасных для окружающей среды, и других, менее популярных в повседневном применении, таких как воздушно-цинковые или серебряные батареи.
Наконец, примечание, которое относится ко всем типам одноразовых ячеек. Несмотря на различные попытки многих людей, одноразовые элементы не подходят для регенерации и не должны заряжаться! Химические процессы, происходящие в электролите, не могут быть обращены зарядкой, в то время как газ, выделяющийся во время протекания тока, может вызвать взрыв и взрыв элемента.
Источники:
- mlodytechnik.pl/eksperymenty-i-zadania-szkolne/chemia/4695-ogniwa-uzywane-wspolczesnie
- www.energizer.eu/pl/battery-history/
- pl.
 wikipedia.org/wiki/Bateria_ogniw
wikipedia.org/wiki/Bateria_ogniw - telefix.ugu.pl/baterie.htm
23.7: Батареи — Chemistry LibreTexts
- Последнее обновление
- Сохранить как PDF
- Батареи
- Сухие элементы
- Свинцовые аккумуляторы
- Резюме
- Авторы и авторства
Алессандро Вольта разработал первый «гальванический элемент» в 1800 году.Эта батарея состояла из чередующихся дисков из цинка и серебра с кусочками картона, пропитанными рассолом, разделяющими диски. Поскольку в то время не было вольтметров (и понятия не было, что электрический ток был вызван потоком электронов), Вольте пришлось полагаться на другой показатель прочности батареи: количество произведенного удара (никогда не стоит проверять что-то на себе. ). Он обнаружил, что интенсивность удара возрастает с увеличением количества металлических пластин в системе. Приборы с двадцатью пластинами вызвали довольно болезненный шок.Хорошо, что у нас сегодня есть вольтметры для измерения электрического тока, а не метод «ткни пальцем в это и скажи мне, что ты чувствуешь».
Батареи
Два варианта основного гальванического элемента — это сухой элемент и свинцовая аккумуляторная батарея.
Сухие камеры
Многие обычные батареи, такие как те, которые используются в фонариках или пультах дистанционного управления, представляют собой сухие гальванические элементы. Эти батареи называются сухими элементами, потому что электролит представляет собой пасту. Они относительно недороги, но служат недолго и не подлежат перезарядке.
Рисунок \ (\ PageIndex {1} \): Цинк-угольный сухой элемент. В сухом цинково-углеродном элементе анодом является цинковый контейнер, а катодом — углеродный стержень, проходящий через центр элемента. -} \]
-} \]
Преимущества щелочной батареи в том, что она имеет более длительный срок хранения и не снижается напряжение во время использования.
Свинцовые аккумуляторы
Батарея — это группа электрохимических ячеек, объединенных вместе в качестве источника постоянного электрического тока при постоянном напряжении. Сухие элементы не являются настоящими батареями, поскольку они состоят только из одного элемента. Свинцовая аккумуляторная батарея обычно используется в качестве источника энергии в автомобилях и других транспортных средствах. Он состоит из шести соединенных вместе идентичных ячеек, каждая из которых имеет свинцовый анод и катод из оксида свинца (IV) \ (\ left (\ ce {PbO_2} \ right) \), упакованные на металлическую пластину.{2-}} \ left (aq \ right) \ rightarrow 2 \ ce {PbSO_4} \ left (s \ right) + 2 \ ce {H_2O} \ left (l \ right) \]
Каждая ячейка свинцовой аккумуляторной батареи производит \ (2 \: \ text {V} \), так что всего \ (12 \: \ text {V} \) генерируется всей батареей. Он используется для запуска автомобиля или питания других электрических систем.
В отличие от сухих элементов свинцовая аккумуляторная батарея является перезаряжаемой. Обратите внимание, что прямая окислительно-восстановительная реакция генерирует твердый сульфат свинца (II), который медленно накапливается на пластинах. Дополнительно снижается концентрация серной кислоты.{2-}} \ left (aq \ right) \]
Эта реакция восстанавливает свинец, оксид свинца (IV) и серную кислоту, необходимые для правильного функционирования батареи. Теоретически свинцовый аккумулятор должен работать вечно. На практике перезарядка неэффективна на \ (100 \% \), потому что часть сульфата свинца (II) падает с электродов и собирается на дне ячеек.
Сводка
- Приведены конструкции сухого элемента и батареи.
- Описаны химические реакции обоих типов.
Авторы и авторство
Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Жан Дюпон.

Архив часто задаваемых вопросов — Duracell AR
Показать спрятатьМогу ли я использовать аккумуляторы Plus Power для всех устройств?
Батареи Duracell Plus Power обеспечивают надежную работу всех ваших устройств.
Показать спрятатьЕсть ли в Duracell Ultra Power Powercheck ™ на батарее?
Да, в каждой батарее Duracell Ultra Power есть POWERCHECK ™. POWERCHECK ™ — это встроенный тестер, который всегда позволяет узнать, сколько энергии осталось в вашей батарее.
Показать спрятатьЧем батареи Duracell Hearing Aid отличаются от батареек других слуховых аппаратов?
Батарейки для слуховых аппаратов Duracell просты в использовании, они поставляются в удобной пластиковой коробке и имеют удлиненный язычок для удобной установки в устройство.
НАЛИЧИЕ ПРОДАЖИ Кролика?
К сожалению, Duracell Bunny не продается.
Показать спрятатьКАК ЗАНИМАЛИСЬ ЗАЙКА ДУРАСЕЛЬ?
Это началось в 1973 году, когда была разработана революционная реклама, чтобы сообщить, что щелочные батареи Duracell служат намного дольше, чем обычные и недорогие угольно-цинковые батареи.Был создан маленький розовый пушистый кролик, который, питаясь от батареек Duracell, смог пережить всех остальных в множестве красочных испытаний.
Показать спрятатьЧТО ТАКОЕ АНОД, КАТОД И ЭЛЕКТРОЛИТ?
Это основные компоненты батареи, как и другие щелочные батареи: Анод — это отрицательный электрод, он сделан из цинка.Катод является положительным электродом и изготовлен из диоксида марганца.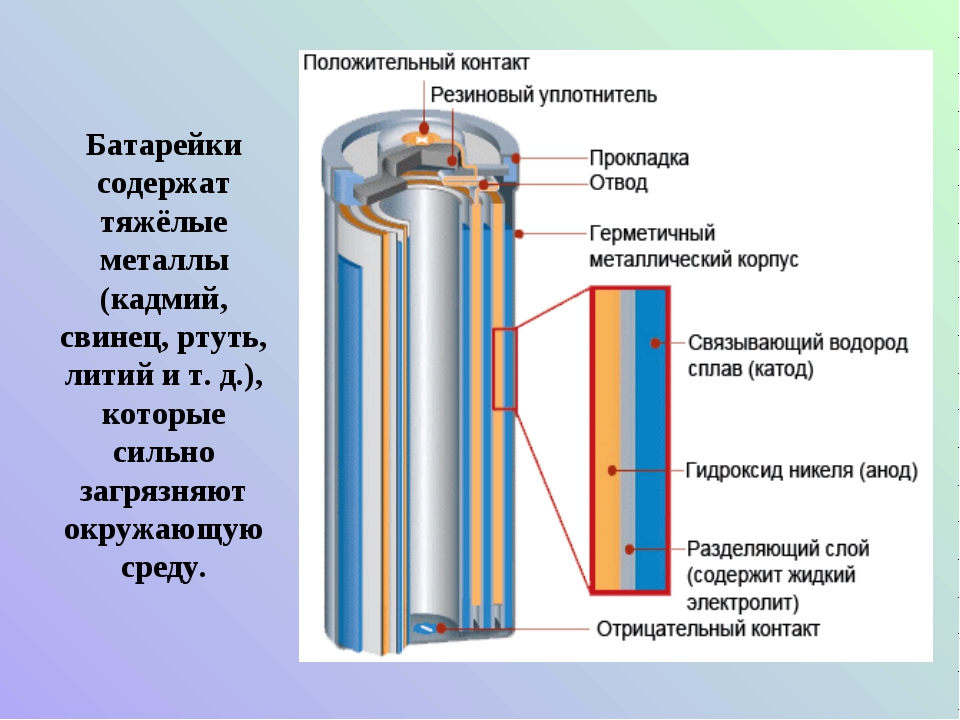 Электролит представляет собой водный раствор, который обеспечивает перенос ионов между электродами и состоит из гидроксида калия.
Электролит представляет собой водный раствор, который обеспечивает перенос ионов между электродами и состоит из гидроксида калия.
Можно ли зажечь аккумулятор?
НИКОГДА не зажигайте батареи и не бросайте их в огонь — они могут взорваться, разорваться и создать угрозу безопасности.
Показать спрятатьМОЖНО ЛИ ИСПОЛЬЗОВАТЬ АККУМУЛЯТОРЫ НА ЛЮБОМ УСТРОЙСТВЕ?
Вы можете использовать перезаряжаемые круглые элементы абсолютно в любом устройстве, где вы обычно используете щелочную батарею, если иное не указано производителем устройства. Использование перезаряжаемых аккумуляторов, отличных от марки устройства, не вызывает помех.(Обратите внимание, что это относится к аккумуляторным батареям с круглыми элементами, литиевые батареи разной формы часто разрабатываются производителем специально для того, чтобы соответствовать определенному размеру гнезда, и поэтому работать может только фирменный аккумулятор).
Показать спрятатьЧТО ИЗ ГАДЖЕТОВ ВЫ НЕ ЧАСТО ИСПОЛЬЗУЕТЕ? СЛИЕТ ЛИ АККУМУЛЯТОР САМОСТОЯТЕЛЬНО, ЕСЛИ ГАДЖЕТЫ НЕ ИСПОЛЬЗУЮТСЯ В течение некоторого времени?
Стандартные аккумуляторные батареи разряжаются сверхурочно, поэтому они не идеальны для устройств, которые не используются часто, или оборудования с низким энергопотреблением.
В КАКИХ УСТРОЙСТВАХ НЕ СЛЕДУЕТ ИСПОЛЬЗОВАТЬ АККУМУЛЯТОРНЫЕ БАТАРЕИ?
Вы можете использовать аккумуляторные батареи абсолютно в любом устройстве, где вы обычно используете щелочные батареи, если иное не указано производителем устройства. Использование перезаряжаемых аккумуляторов, отличных от марки устройства, не вызывает помех.
Показать спрятатьКАКИЕ АККУМУЛЯТОРЫ DURACELL НАИЛУЧШИЕ ДЛЯ МОИХ ПОВСЕДНЕВНЫХ УСТРОЙСТВ НАПР. ПУЛЬТ ДИСТАНЦИОННОГО УПРАВЛЕНИЯ, ЦИФРОВАЯ КАМЕРА, MP3-ПЛЕЕР И МОТОРИЗОВАННЫЕ ИГРУШКИ?
Duracell Ultra Power — лучшая и самая мощная щелочная батарея от Duracell для всех устройств.
Показать спрятатьКАКАЯ БАТАРЕЯ ИЗ ЩЕЛОЧНОЙ БАТАРЕИ НАИБОЛЕЕ РАБОТАЕТ С ПОМОЩЬЮ ПОРТФЕЛЯ?
Duracell Ultra Power — самая мощная щелочная батарея Duracell среди всех устройств
Показать спрятатьГде я могу купить продукцию Duracell?
Прямо здесь, на Duracell. co.uk. На странице с подробными сведениями о каждом продукте вы можете найти интернет-магазины, в которых продается этот продукт, и узнать, есть ли он в наличии или нет. Вы также должны быть в состоянии найти многие из наших продуктов в обычных магазинах, таких как аптеки, рынки, универмаги, складские магазины и магазины канцелярских товаров, или как массовые товары.
co.uk. На странице с подробными сведениями о каждом продукте вы можете найти интернет-магазины, в которых продается этот продукт, и узнать, есть ли он в наличии или нет. Вы также должны быть в состоянии найти многие из наших продуктов в обычных магазинах, таких как аптеки, рынки, универмаги, складские магазины и магазины канцелярских товаров, или как массовые товары.
Как вы отреагируете на недавнее сравнительное тестирование аккумуляторов сторонних производителей с аккумуляторами других производителей?
Duracell — это бренд №1, которому доверяют потребители во всем мире.Производительность батареи — это не одномерное измерение; несколько параметров, которые влияют на рабочие характеристики: характеристики разряда, напряжение, плотность энергии, влияние разрядной нагрузки и температуры, а также срок годности. Технические бюллетени с подробной информацией по каждому типу батарей доступны в Технической библиотеке. Тестирование наших разработок как в лабораторных условиях (в соответствии с методологиями IEC), так и в реальных исследованиях использования гарантирует, что наши инновации будут постоянно радовать наших потребителей.
Показать спрятатьСледует ли хранить батареи в холодильнике или морозильнике?
Мы рекомендуем хранить батареи при комнатной температуре в сухом месте. Сильная жара или холод снижает производительность аккумулятора. Не кладите устройства с батарейным питанием в очень жаркие места.Кроме того, охлаждение не требуется и не рекомендуется.
Сильная жара или холод снижает производительность аккумулятора. Не кладите устройства с батарейным питанием в очень жаркие места.Кроме того, охлаждение не требуется и не рекомендуется.
Следует ли вынимать батареи из устройства, если я не собираюсь им пользоваться какое-то время?
Да. Выньте батареи из устройства, если предполагается, что оно не будет использоваться в течение нескольких месяцев.
Показать спрятатьКак очистить аккумулятор после утечки?
Следуйте этим советам, чтобы очистить аккумулятор после протечки: Работайте в хорошо проветриваемом помещении.Надевайте хозяйственные перчатки и очки. Используя зубную щетку или ватный тампон, удалите утечку батареи из электрических контактов. Прежде чем пробовать новую батарею, убедитесь, что электронное устройство полностью высохло. Чтобы избежать проблем в будущем, придерживайтесь следующих правил:
Не используйте одновременно батареи разных производителей в одном устройстве.
Удалите батареи из устройств, которые хранятся.
Для устранения утечки из следующих типов батарей, щелочных, никель-кадмиевых и никель-металлгидридных батарей, используйте либо одну столовую ложку борной кислоты на один галлон воды, либо смесь равных количеств разбавленного уксуса или лимонного сока с водой (соотношение 50/50).
Как батареи Duracell влияют на окружающую среду?
В 1993 году мы добровольно исключили ртуть из наших батарей. «Наши щелочные батареи состоят в основном из обычных материалов — стали, цинка и марганца — и не представляют опасности для здоровья или окружающей среды при нормальном использовании или утилизации.Более того, мы идем на экологически чистую продукцию, отказываясь от кожухов из ПВХ и заменяя их картами с высоким содержанием клетчатки и блистерами из RPET (переработанного ПЭТ). Это комплексное экологически безопасное упаковочное решение, одна из лучших альтернатив ПВХ, доступных сегодня. Как ведущий мировой производитель щелочных батарей с высокими эксплуатационными характеристиками, мы осознаем свою ответственность за защиту окружающей среды. Мы стремимся разрабатывать, производить и распространять аккумуляторы таким образом, чтобы минимизировать воздействие на окружающую среду.Мы также участвуем в программе Call2Recycle, чтобы обеспечить безопасную и надлежащую переработку или утилизацию батарей ».
Показать спрятатьАккумулятор какого типа следует использовать при экстремальных температурах?
Если оборудование необходимо периодически использовать при экстремальных температурах, рекомендуется использовать щелочные батареи премиум-класса. Эти типы батарей работают в таких условиях намного лучше, чем угольно-цинковые батареи
Эти типы батарей работают в таких условиях намного лучше, чем угольно-цинковые батареи
Могу ли я использовать батареи под водой или в других условиях вакуума?
Нет, батареи Duracell не предназначены для использования под водой или в условиях вакуума. Ячейки предназначены для использования в нормальных атмосферных условиях и при довольно постоянных температурах (приблизительно 21 ° C / 70 ° F).
Показать спрятатьВлияют ли батареи на температуру?
Мы рекомендуем хранить батареи при комнатной температуре в сухом месте. Сильная жара или холод снижает производительность аккумулятора. Не кладите устройства с батарейным питанием в очень жаркие места. Кроме того, охлаждение не требуется и не рекомендуется.
Показать спрятатьВ какую сторону идут + и -?
Внимательно следуйте инструкциям на вашем оборудовании относительно правильной установки батарей, следя за тем, чтобы клеммы + (плюс) и — (минус) были правильно выровнены. ВНИМАНИЕ: Некоторое оборудование, использующее три или более батарей, может работать нормально, даже если одна батарея вставлена неправильно; такое использование может привести к утечке или разрыву батареи, что может привести к повреждению оборудования.
ВНИМАНИЕ: Некоторое оборудование, использующее три или более батарей, может работать нормально, даже если одна батарея вставлена неправильно; такое использование может привести к утечке или разрыву батареи, что может привести к повреждению оборудования.
На батарейках есть китайские буквы. Что это значит?
Символы указывают на то, что батареи не содержат ртути.
Показать спрятатьСледует ли зажигать аккумулятор?
НИКОГДА не зажигайте батареи и не бросайте их в огонь — они могут взорваться, разорваться и создать угрозу безопасности.
Показать спрятатьМой ребенок любит играть с батарейками. Это нормально?
Маленькие дети не должны играть с батарейками. Батареи предназначены для питания устройств, и с ними нельзя играть по отдельности. Помните, что, хотя батареи являются популярными и обычными устройствами, они генерируют портативную энергию за счет мощных химических реакций.Запрещается разбирать батареи, использовать их не по назначению, обращаться с ними не по назначению или обращаться с ними как с игрушками. Хотя большинство батарей содержат химические вещества, которые не повреждают открытые участки кожи, с ними все равно следует обращаться, как с любыми химическими веществами. Всегда соблюдайте меры предосторожности при обращении с открытыми химикатами батареи. Химические вещества из аккумулятора не должны находиться рядом с глазами или проглатываться. Если это произойдет, немедленно обратитесь к врачу. В целях безопасности использование батареек детьми должно находиться под пристальным вниманием ответственных взрослых.
Батареи предназначены для питания устройств, и с ними нельзя играть по отдельности. Помните, что, хотя батареи являются популярными и обычными устройствами, они генерируют портативную энергию за счет мощных химических реакций.Запрещается разбирать батареи, использовать их не по назначению, обращаться с ними не по назначению или обращаться с ними как с игрушками. Хотя большинство батарей содержат химические вещества, которые не повреждают открытые участки кожи, с ними все равно следует обращаться, как с любыми химическими веществами. Всегда соблюдайте меры предосторожности при обращении с открытыми химикатами батареи. Химические вещества из аккумулятора не должны находиться рядом с глазами или проглатываться. Если это произойдет, немедленно обратитесь к врачу. В целях безопасности использование батареек детьми должно находиться под пристальным вниманием ответственных взрослых.
Моя батарея намокла, и теперь на ней белая порошкообразная субстанция.Что мне делать?
В том маловероятном случае, если аккумулятор намокнет или покрыт белым порошкообразным веществом, ограничьте обращение с аккумулятором. Обращайтесь с аккумулятором только так, как это требуется для надлежащего удаления и утилизации, и немедленно мойте все открытые поверхности тела и одежду водой с мылом. При попадании в глаза немедленно промойте глаза проточной водой в течение не менее 15 минут, а затем немедленно обратитесь за медицинской помощью.
Показать спрятатьКак обращаться с батареями, которые протекли в устройстве?
Хотя большинство батарей содержат химические вещества, которые не повреждают открытые участки кожи, с ними все равно следует обращаться, как с любыми химическими веществами. Всегда соблюдайте меры предосторожности при обращении с открытыми химикатами батареи. Химические вещества из аккумулятора не должны находиться рядом с глазами или проглатываться. Если это произойдет, немедленно обратитесь к врачу.
Всегда соблюдайте меры предосторожности при обращении с открытыми химикатами батареи. Химические вещества из аккумулятора не должны находиться рядом с глазами или проглатываться. Если это произойдет, немедленно обратитесь к врачу.
Ваши батареи содержат ртуть?
Нет, все версии батарей Duracell не содержат ртути.Мы гордимся тем, что добровольно прекратили использование ртути в наших батареях общего назначения (размеры AAA, AA, C, D и 9 В) в 1993 году. Наши щелочные батареи изготавливаются в основном из обычных металлов, стали, цинка и марганца, и не представляют опасности. для здоровья или окружающей среды, если они используются и утилизируются надлежащим образом. Все батарейки для слуховых аппаратов не содержат ртути с января 2011 года в соответствии с Законом о ртутьсодержащих и перезаряжаемых батареях.
Показать спрятатьМожно ли разобрать аккумулятор?
Нет.Не разбирайте батареи. Когда аккумулятор разобран, контакт с компонентами может быть опасным и может вызвать травмы или возгорание.
Показать спрятать Is it normal?", "event":"duEvent"}»> Аккумулятор в кармане нагрелся. Это нормально?Нет, батареи не должны нагреваться, когда они не используются. Мы печатаем предупреждение на нашей упаковке, предупреждающее потребителей, что нельзя носить с собой и хранить батарейки в кармане или сумочке.Они могут закоротиться при контакте с металлическими предметами, протечь или разорваться и стать причиной травм.
Показать спрятатьКто придумал батарею?
В 1860-х годах Жорж Лекланш из Франции разработал то, что должно было стать предшественником первой в мире широко используемой батареи; цинк-углеродный элемент.Анодом служил стержень из сплава цинка и ртути (цинк, анод в оригинальной ячейке Алессандро Вольта, оказался одним из лучших металлов для этой работы). Катод представлял собой пористую чашку из измельченного диоксида марганца и небольшого количества углерода. В смесь был вставлен угольный стержень, который действовал как токоприемник. И анод, и катодная чашка были погружены в жидкий раствор хлорида аммония, который действовал как электролит. Система получила название «мокрая камера». Хотя камера Лекланша была прочной и недорогой, в конце концов ее заменили улучшенной «сухой камерой» в 1880-х годах.Анод стал цинковой банкой, в которой находился элемент, а электролит стал пастой, а не жидкостью; в основном это углеродно-цинковые элементы, известные сегодня.
Показать спрятатьЧто внутри батареи?
Батареи могут быть небольшими, но они далеко не простые. Это высокотехнологичные электрохимические элементы.Химическая энергия преобразуется в электрическую в результате окислительно-восстановительной реакции. Этот процесс происходит между тремя основными частями батареи: анодом, катодом и электролитом. В разных типах батарей используются разные материалы для этих деталей. Материалы для этих деталей выбираются в зависимости от того, насколько хорошо они отдают или притягивают электроны, что должно произойти для генерации электрического тока. Анодом часто является металл, катод — оксид металла, а электролит — раствор соли, который облегчает поток ионов.
Это высокотехнологичные электрохимические элементы.Химическая энергия преобразуется в электрическую в результате окислительно-восстановительной реакции. Этот процесс происходит между тремя основными частями батареи: анодом, катодом и электролитом. В разных типах батарей используются разные материалы для этих деталей. Материалы для этих деталей выбираются в зависимости от того, насколько хорошо они отдают или притягивают электроны, что должно произойти для генерации электрического тока. Анодом часто является металл, катод — оксид металла, а электролит — раствор соли, который облегчает поток ионов.
Что такое щелочная батарея?
Duracell впервые разработала электрохимическую систему на основе щелочного диоксида марганца почти 40 лет назад. В 1960-х годах эта система батарей быстро стала популярным выбором дизайнеров в постоянно расширяющейся области бытовой электроники.Щелочные или щелочные элементы из диоксида марганца имеют много преимуществ по сравнению с углеродно-цинковыми элементами, в том числе в десять раз больше, чем в ампер-часах, в условиях постоянного и интенсивного дренажа. Кроме того, его характеристики при низких температурах превосходят другие традиционные первичные элементы с водным электролитом. Другими значительными преимуществами являются более длительный срок хранения, лучшая устойчивость к утечкам и превосходные низкотемпературные характеристики. Его более эффективное и надежное уплотнение обеспечивает превосходную устойчивость к утечкам и коррозии.Сегодня Duracell производит три щелочные батареи: Ultra Power, Plus Power и Simply.
Почему выбирают зарядные устройства Duracell?
Если вы устали всю ночь ждать зарядки аккумуляторов, зарядные устройства Duracell — идеальное решение для вас. Duracell предлагает четыре разные модели зарядных устройств, каждая из которых имеет разную специфику и время зарядки, чтобы вы могли найти зарядное устройство, соответствующее вашим потребностям: «Зарядное устройство Expert на 15 минут», «Зарядное устройство Advanced Charger на 45 минут», «Зарядное устройство на 1 час» или «Зарядное устройство Value».А поскольку скорость зарядного устройства имеет значение, зарядные устройства Duracell заряжаются быстрее, чем самые продаваемые в мире конкуренты *. * При использовании батареек AA такой же емкости. На основе данных о продажах Nielsen.
Показать спрятатьВ каких устройствах нельзя использовать аккумуляторные батареи?
Вы можете использовать аккумуляторные батареи абсолютно в любом устройстве, где вы обычно используете щелочные батареи, если иное не указано производителем устройства.Использование перезаряжаемых аккумуляторов, отличных от марки устройства, не вызывает помех.
Как следует утилизировать батареи?
Все батареи следует утилизировать. Батареи нельзя выбрасывать вместе с бытовыми отходами, их следует сдавать в пункты сбора батарей для вторичной переработки.
Показать спрятатьКакая щелочная батарея из линейки Duracell является лучшей с точки зрения производительности?
Duracell Ultra Power — наш аккумулятор номер 1 с самым продолжительным сроком службы для всех устройств.
Показать спрятатьУ всех батарей одинаковое время работы?
Нет, разные батареи обеспечивают разный срок службы и выходную мощность в зависимости от типа и количества химикатов, используемых для их создания.Думайте об этом как о приготовлении еды: использование разных ингредиентов и разных количеств делает вкус еды другим.
Как работает аккумулятор?
Батареи могут показаться простыми, но доставка комплектного питания — сложный электрохимический процесс. Электрический ток в форме электронов начинает течь во внешней цепи, когда устройство — например, лампочка — включается.В это время материал анода, цинк, отдает два электрона на атом в процессе, называемом окислением, оставляя после себя нестабильные ионы цинка. После того, как электроны выполняют свою работу по питанию лампочки, они снова входят в элемент на катоде, где они соединяются с активным материалом, диоксидом марганца, в процессе, называемом восстановлением. Комбинированные процессы окисления и восстановления не могли бы происходить в силовой ячейке без внутреннего способа переноса электронов обратно к аноду, уравновешивая внешний поток тока.Этот процесс достигается за счет движения отрицательно заряженных гидроксид-ионов, присутствующих в водном растворе, называемом электролитом. Каждый электрон, попадающий на катод, реагирует с диоксидом марганца с образованием MnOO-. Затем MnOO- вступает в реакцию с водой из электролита. В этой реакции вода расщепляется, высвобождая ионы гидроксида в электролит и ионы водорода, которые объединяются с MnOO- с образованием MnOOH. Внутренний контур замыкается, когда гидроксид-ионы, образующиеся в этой реакции на катоде, текут на анод в виде ионного тока.Там они соединяются с нестабильными ионами цинка, которые образовывались на аноде, когда электроны изначально попадали во внешнюю цепь. Это производит оксид цинка и воду. Это замыкает цепь (которая необходима для постоянного тока электричества) и приводит в действие ваш фонарик.
Как увеличить срок службы батарей?
Вот несколько советов, которые помогут продлить срок службы ваших батарей.- Выключайте радиоприемники и бытовые электроприборы с батарейным питанием, когда они не используются
- Извлеките батареи из устройств, которые не будут использоваться в течение некоторого времени
- Храните батареи в сухом месте при нормальной комнатной температуре, не касаясь контактами
Аккумулятор какого типа следует использовать при экстремальных температурах?
Если оборудование необходимо периодически использовать при экстремальных температурах, рекомендуется использовать щелочные батареи премиум-класса, поскольку в таких условиях они работают намного лучше, чем угольно-цинковые батареи.
Показать спрятатьСледует чистить батарейный отсек?
Для оптимальной работы держите контактные поверхности аккумулятора и контакты аккумуляторного отсека в чистоте. Протирайте их чистым ластиком для карандашей или чистой тканью каждый раз при замене батареек.
Протирайте их чистым ластиком для карандашей или чистой тканью каждый раз при замене батареек.
Когда мне следует извлекать батареи из моего устройства?
Батареи следует снимать с устройств / оборудования в следующих случаях:- Предполагается, что устройство не будет использоваться в течение нескольких месяцев
- Батареи изношены (для предотвращения возможного повреждения в результате протечки батареи)
- Устройство работает от бытового (переменного) тока
Зачем нужна никель-металлогидридная (NiMH) аккумуляторная батарея?
Многие из современных устройств с высоким энергопотреблением, таких как цифровые фотоаппараты, требуют замены батарей чаще, чем вы привыкли. Почему бы не выбрать никель-металлгидридные батареи Duracell? Их можно заряжать сотни раз.Аккумуляторная батарея Duracell AA идеально подходит для питания цифровых фотоаппаратов и других устройств, требующих большого количества энергии. Также доступны батарейки AAA, которые можно использовать в небольших электронных устройствах, таких как MP3-плееры и портативные игры. Никель-металлгидридные аккумуляторные батареи и зарядные устройства Duracell предлагают вам качество и надежность, которым вы доверяете от Duracell, в виде долговечного и экономичного варианта питания.
Никель-металлгидридные аккумуляторные батареи и зарядные устройства Duracell предлагают вам качество и надежность, которым вы доверяете от Duracell, в виде долговечного и экономичного варианта питания.
Можно ли заряжать щелочные батареи?
Заряжать следует только батареи, специально помеченные как «перезаряжаемые».Любая попытка перезарядить неперезаряжаемую батарею может привести к разрыву или утечке.
Показать спрятатьИмеет ли значение, какой тип батарей я использую в своем устройстве?
Всегда заменяйте батарею или батареи в вашем оборудовании на размер и тип, указанные производителем.Щелочные батареи часто рекомендуются для наилучшей работы, потому что угольно-цинковые батареи имеют меньший срок службы, и оборудование может работать неправильно, если используются угольно-цинковые батареи.
Показать спрятатьВ чем разница между литием и щелочью?
Литиевые и щелочные батареи имеют разный химический состав для достижения максимальной производительности в разных устройствах. Легкие и компактные литиевые батареи часто бывают разных размеров для использования в определенных устройствах.
Легкие и компактные литиевые батареи часто бывают разных размеров для использования в определенных устройствах.
Какая из щелочных батарей из ассортимента лучшая по производительности?
Duracell Ultra Power — самая мощная щелочная батарея Duracell среди всех устройств.
Показать спрятатьОбязательно ли менять все батареи одновременно?
Мы рекомендуем заменять все батареи в устройстве одновременно. Частично использованный аккумулятор истощает энергию нового, уменьшая общий доступный заряд аккумулятора.
Показать спрятатьМогу ли я одновременно использовать старые и новые батареи?
Не смешивайте старые и новые батареи.Это снизит общую производительность и может вызвать протечку или разрыв батареи. Мы рекомендуем заменять все батареи в устройстве.
Мы рекомендуем заменять все батареи в устройстве.
Могу ли я использовать разные типы батарей одновременно?
Нет, разные батареи предназначены для разных целей. Использование литиевой батареи с щелочной батареей не улучшит работу устройства.Фактически, это снизит производительность и может даже повредить ваше устройство или вызвать утечку или разрыв батареи. Также не используйте одновременно батареи разных производителей в одном устройстве. Это снизит общую производительность, а также может вызвать протечку или разрыв батареи. Мы рекомендуем использовать в устройстве батареи одного типа.
Цинково-ионные аккумуляторные батареи: акцент на цинк-металлические аноды
Несмотря на преобладание литий-ионных аккумуляторов в современных технологиях, поиск альтернативных электрохимических систем, дополняющих глобальный портфель аккумуляторов, продолжается.Поиск привел к многочисленным кандидатам, среди которых слабокислые водные ионно-цинковые батареи недавно вызвали значительный академический интерес, в основном из-за присущей им безопасности. Поскольку в этих системах анод часто фиксируется как металлический цинк, в большинстве исследований рассматривается отсутствие подходящего катода для реакции с ионами цинка. Это привело к активным исследованиям жизнеспособных катодов интеркаляции, некоторые из которых показали впечатляющие результаты. Однако во многих исследованиях часто упускается из виду значение металлического цинкового анода, хотя на самом деле анод является ключом к определению плотности энергии всего элемента. В связи с этим мы стремимся пролить свет на важность металлического цинкового анода. Эта перспектива предлагает краткое обсуждение электрохимии цинка в слабокислой водной среде, а также обзор недавних попыток улучшить характеристики металлического цинка, чтобы извлечь ключевые уроки для будущих исследовательских инициатив. Кроме того, мы обсуждаем разветвления плотности энергии цинкового анода в зависимости от его веса и обратимости посредством простых вычислений для многочисленных влиятельных отчетов в этой области.Наконец, мы предлагаем некоторые точки зрения на важность оптимизации цинковых анодов, а также на будущее направление разработки высокоэффективных водных цинково-ионных батарей.
В связи с этим мы стремимся пролить свет на важность металлического цинкового анода. Эта перспектива предлагает краткое обсуждение электрохимии цинка в слабокислой водной среде, а также обзор недавних попыток улучшить характеристики металлического цинка, чтобы извлечь ключевые уроки для будущих исследовательских инициатив. Кроме того, мы обсуждаем разветвления плотности энергии цинкового анода в зависимости от его веса и обратимости посредством простых вычислений для многочисленных влиятельных отчетов в этой области.Наконец, мы предлагаем некоторые точки зрения на важность оптимизации цинковых анодов, а также на будущее направление разработки высокоэффективных водных цинково-ионных батарей.
Эта статья в открытом доступе
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуйте еще раз? Висмутспособствует образованию неупорядоченного бирнессита в перезаряжаемых щелочных батареях
Существует потребность в недорогих, безопасных и нетоксичных химических перезаряжаемых батареях, которые можно использовать в масштабах энергосистемы, для буферизации прерывистой выработки возобновляемой энергии.Наиболее распространенной перезаряжаемой системой является литий-ионная технология с графитовым анодом, оксидом металлического лития или фосфатным катодом и электролитом на основе органического карбоната из-за высокой удельной емкости и мощности с достижимым сроком службы в тысячи циклов. Однако неводные системы исторически были дорогими и имели серьезные проблемы с безопасностью из-за теплового разгона и легковоспламеняющихся электролитов. 1 Щелочная батарея Zn / MnO 2 недавно вызвала интерес как безопасная, масштабируемая и недорогая система из-за анализа моделирования, показывающего, что достижимы затраты ниже 50 долларов США за киловатт-час. 2,3 Эти щелочные системы обычно описываются как первичные системы, хотя в работе Ford Motor Company в конце 1980-х годов сообщалось о физических смесях материалов, содержащих Bi 3+ или Pb 2+ , с катодом MnO 2 . может увеличить цикличность до сотен циклов. 4,5 Это привело к серьезным исследованиям этих систем, но производительность была ограничена сроком службы менее 1000 циклов, окислительно-восстановительной активностью менее 2 электронных эквивалентов и емкостью <6 мАч см −2 . 5–9 Чтобы воспользоваться экономическими преимуществами щелочных катодов MnO 2 , емкость поверхности должна быть> 15 мАч см −2 . 10
Однако неводные системы исторически были дорогими и имели серьезные проблемы с безопасностью из-за теплового разгона и легковоспламеняющихся электролитов. 1 Щелочная батарея Zn / MnO 2 недавно вызвала интерес как безопасная, масштабируемая и недорогая система из-за анализа моделирования, показывающего, что достижимы затраты ниже 50 долларов США за киловатт-час. 2,3 Эти щелочные системы обычно описываются как первичные системы, хотя в работе Ford Motor Company в конце 1980-х годов сообщалось о физических смесях материалов, содержащих Bi 3+ или Pb 2+ , с катодом MnO 2 . может увеличить цикличность до сотен циклов. 4,5 Это привело к серьезным исследованиям этих систем, но производительность была ограничена сроком службы менее 1000 циклов, окислительно-восстановительной активностью менее 2 электронных эквивалентов и емкостью <6 мАч см −2 . 5–9 Чтобы воспользоваться экономическими преимуществами щелочных катодов MnO 2 , емкость поверхности должна быть> 15 мАч см −2 . 10
Для полного использования перезаряжаемой батареи Zn / MnO 2 потребуется преобразование в Mn 2+ , которое будет обратимым на протяжении тысяч циклов. 2-электронная реакция, приводящая к 617 мАч г -1 , протекает следующим образом:
Способность образовывать Mn (OH) 2 сильно зависит от pH раствора электролита.В кислых условиях Mn 2+ растворим и ограничивает разгрузку материалов оксида марганца до 1-электронного переноса (308 мАч г -1 ). 11 Таким образом, использование щелочных электролитов на основе КОН по сравнению с водными солями цинка в слабокислом растворе удваивает доступную емкость материалов на основе оксида марганца. Способность разряда к оксидам или гидроксидам Mn 2+ была ограничена и обычно происходит только при добавлении компонента электрода, такого как Bi 2 O 3 . Предыдущие исследования предположили, что присутствие Bi 3+ может потенциально катализировать восстановление Mn 3+ до Mn 2+ и что при последующей загрузке способствует образованию слоистой структуры бирнессита MnO 2 . 12 Восстановление Mn 3+ имеет решающее значение, поскольку присутствие Mn 3+ связано с необратимым фазовым переходом в структуру шпинели Mn 3 O 4 , которая, как было показано, подавляется с помощью Bi 2 О 3 электроды модифицированные. 12,13 Другое отдельное исследование показало, что присутствие Bi 3+ предотвращает образование фазы шпинели за счет образования комплексов Bi-Mn, которые не могут образовывать стабильную решетку шпинели. 7 Эти результаты обычно основывались на дифракции ex situ для определения структурных характеристик и имели ограниченную циклическую способность менее 2 электронных эквивалентов со значительным затуханием в течение первых 100 циклов.
Предыдущие исследования предположили, что присутствие Bi 3+ может потенциально катализировать восстановление Mn 3+ до Mn 2+ и что при последующей загрузке способствует образованию слоистой структуры бирнессита MnO 2 . 12 Восстановление Mn 3+ имеет решающее значение, поскольку присутствие Mn 3+ связано с необратимым фазовым переходом в структуру шпинели Mn 3 O 4 , которая, как было показано, подавляется с помощью Bi 2 О 3 электроды модифицированные. 12,13 Другое отдельное исследование показало, что присутствие Bi 3+ предотвращает образование фазы шпинели за счет образования комплексов Bi-Mn, которые не могут образовывать стабильную решетку шпинели. 7 Эти результаты обычно основывались на дифракции ex situ для определения структурных характеристик и имели ограниченную циклическую способность менее 2 электронных эквивалентов со значительным затуханием в течение первых 100 циклов.
Недавно Yadav et al. сообщили о щелочной батарее Zn / MnO 2 с добавкой Bi 2 O 3 и включением Cu в архитектуру электрода, которая продемонстрировала стабильную циклическую работу в течение более 6000 циклов с массовыми нагрузками, обеспечивающими> 25 мАч см -2 . 10,14–17 Последующие исследования этой системы показывают, что образование Mn 3 O 4 подавляется во время разряда, а последующий заряд формирует фазу бирнессита с интеркалированной медью. 16 После первого цикла фаза γ, -MnO 2 не подвергается преобразованию, а фаза бирнессита обратимо превращается в Mn (OH) 2 в результате длительного цикла. 15 В этой системе Mn, Bi и Cu проявляют значительную окислительно-восстановительную активность, и было предложено полагаться на реакцию растворения-осаждения, которая может привести к образованию сложных промежуточных продуктов в фазе раствора. 15,16 Имеются некоторые экспериментальные и теоретические доказательства наличия комплексов Bi-Mn в начальном разряде. 18,19 Однако это не объясняет прямого влияния добавки висмута на механистическое образование фазы бирнессита. Таким образом, в данном исследовании делается попытка понять, какую роль конкретно играет добавка Bi 2 O 3 в фазе обратимого бирнессита с использованием бирнессита калия в качестве исходного электродного материала из оксида марганца.Начиная с активного материала на основе калиевого бирнессита, мы избегаем сложного первого цикла, в котором γ -MnO 2 превращается в бирнессит, и сосредотачиваемся только на обратимом участке реакции. Хотя было высказано предположение, что составляющие Cu имеют решающее значение для долгосрочного цикла, это исследование направлено на деконволюцию наблюдений между двумя составляющими (Bi и Cu) и обеспечение полного понимания механистической роли Bi 2 O 3 на разряд и преобразование бирнессита в условиях эксплуатации аккумулятора.
15,16 Имеются некоторые экспериментальные и теоретические доказательства наличия комплексов Bi-Mn в начальном разряде. 18,19 Однако это не объясняет прямого влияния добавки висмута на механистическое образование фазы бирнессита. Таким образом, в данном исследовании делается попытка понять, какую роль конкретно играет добавка Bi 2 O 3 в фазе обратимого бирнессита с использованием бирнессита калия в качестве исходного электродного материала из оксида марганца.Начиная с активного материала на основе калиевого бирнессита, мы избегаем сложного первого цикла, в котором γ -MnO 2 превращается в бирнессит, и сосредотачиваемся только на обратимом участке реакции. Хотя было высказано предположение, что составляющие Cu имеют решающее значение для долгосрочного цикла, это исследование направлено на деконволюцию наблюдений между двумя составляющими (Bi и Cu) и обеспечение полного понимания механистической роли Bi 2 O 3 на разряд и преобразование бирнессита в условиях эксплуатации аккумулятора.
Крайне важно, чтобы разрабатываемые аккумуляторные системы контролировались в рабочих условиях. Предыдущие исследования литий-ионных аккумуляторов и других новых систем накопления энергии выявили множество метастабильных фаз, которые нельзя было идентифицировать с помощью определения характеристик ex situ, и показали успех в эффективном изучении того, как материалы функционируют совместно. Выявление метастабильных фаз и паразитных взаимодействий между компонентами электродов позволило разработать современные аккумуляторные технологии, поскольку возрастает потребность в системах с более высоким энергопотреблением. 20,21 Одним из основных препятствий при проведении характеризации операндо является разработка корпуса элемента, который обеспечивает высокое качество сигнала при характеристике и точно отражает электрохимический отклик, ожидаемый в реальных приложениях. 22,23 Использование энергодисперсионной дифракции рентгеновских лучей (EDXRD) на синхротронных источниках света устраняет это ограничение, поскольку высокоэнергетический белый луч может проникать в корпус элемента и вносить минимальные изменения в корпус элемента. Этот метод также имеет пространственно-временное разрешение, при котором различные местоположения батареи можно индивидуально контролировать, фокусируясь на небольшом измерительном объеме, обычно <5 мм в направлениях x и y с размером z <50 мкм м. 24 EDXRD был жизненно важен для понимания щелочной системы, поскольку показал, что пространственное распределение Mn 3 O 4 зависит от скорости из-за неоднородного распределения тока в электродах с большой площадью поверхности, которые требуют толщины электродов более 100 микрон. 25 Однако для увеличения обратимости щелочной системы в конструкцию электрода необходимо включить другой компонент электрода, Bi 2 O 3 .Чтобы выяснить роль этого компонента, потребовалась мультимодальная структурная характеристика с использованием спектроскопических методов, чтобы более точно контролировать распределение элементов в электроде и окислительно-восстановительное поведение. 18 Пересмотр этой системы с поглощением рентгеновских лучей (XAS) при более высокой частоте отбора проб без этапов электрохимической остановки позволяет более тщательно анализировать степень окисления во время циклирования. В качестве примера, работа с литий-ионным аккумуляторным электродом LiFePO 4 показывает значительное изменение в реакции спектроскопии поглощения рентгеновских лучей вблизи края (XANES) даже с 30-минутным шагом в покое. 26 Кроме того, существует множество примеров использования XANES для отслеживания изменения состояния окисления в водных батареях Zn / MnO 2 , но обычно с небольшой частотой выборки и более медленной электрохимической скоростью. 27,28 Кроме того, спектроскопия комбинационного рассеяния использовалась в псевдоемкостных применениях фаз бирнессита для лучшего понимания межслоевого состава и для обнаружения сильно разупорядоченных нанокристаллических фаз, которые сложно обнаружить с помощью методов, основанных на дифракции. 29 Использование обоих спектроскопических методов обеспечивает целостное понимание как степени окисления, так и структурных характеристик компонентов электрода, а также их динамических изменений во время циклического переключения батарей.
Новые механистические идеи, представленные в этом исследовании, включают понимание превращения Bi 2 O 3 в Bi 0 и частичное образование водных растворенных частиц Bi, которые интеркалируют ионы Bi 3+ в прослойку бирнессита. Это первоначальное включение Bi 3+ в промежуточный слой предотвращает образование фазы Mn 3 O 4 , ограничивая диффузию Mn внутри кристалла. Диффузия Mn обусловлена диспропорционированием Mn 3+ → Mn 4+ + Mn 2+ в структуре бирнессита, что приведет к образованию дефектов в слоях [MnO 6 ] и, в конечном итоге, к распаду на Mn 3 О 4 .Мы называем это явление «диффузией Mn 3+ внутри решетки». При загрузке растворенный Bi 3+ также играет роль в легком реформировании бирнессита. Следует также отметить, что окислительно-восстановительный потенциал Bi способствует увеличению емкости, при этом спектроскопические данные показывают, что вклад удельной емкости приблизительно 75 мАч г -1 возможен в электроде с массовой долей Bi 2 O 3 12%. Если конкретно рассматривать фазу бирнессита, добавки Bi 2 O 3 позволяют двухфазное превращение бирнессита в Mn (OH) 2 раньше в разряде, при более высоких потенциалах, из-за подавления Mn 3 O 4 фаза.Полное превращение Mn (OH) 2 в конце разряда очевидно с помощью спектроскопических и дифракционных методов. По обвинению, нет никаких доказательств промежуточного MnOOH. Вместо этого существует некристаллический неупорядоченный бирнессит, который сначала содержит преимущественно нейтральный H 2 O, вставленный в промежуточный слой, с последующим внедрением ионов, происходящим только при более высоких потенциалах. Дифракционные данные показывают различные межслоевые среды с присутствием в электроде Bi 2 O 3 и без него, что свидетельствует о критическом взаимодействии, которое этот компонент оказывает на стабильность и преобразование фаз типа бирнессита.Исходя из этих наблюдений, во время циклирования оксидов марганца необходимо тщательно учитывать концентрацию и состав ионов в электролите. Наконец, наблюдается, что если образуется фаза бирнессита с интеркалированными ионами, то полное превращение в Mn 4+ недостижимо и должно быть смешанной фазой Mn 3/4 + , но окислительно-восстановительный потенциал из Bi или других электроактивных компонентов добавляет на поставленную мощность.
Синтез и характеристика материалов
Синтез K-бирнессита проводили с использованием модифицированного метода, предложенного Kim et al. 30 Вкратце, KMnO 4 (Sigma Aldrich) измельчали в шаровой мельнице с использованием мельницы SPEX SamplePrep 8000M в течение 30 мин. Затем образец нагревали в трубчатой печи GSL – 1100X при 800 ° C в течение 5 ч со скоростью нарастания температуры 1 ° C мин. –1 на воздухе. Образец промывали деионизированной водой и отделяли вакуумной фильтрацией. ТГА выполняли с использованием SDT-Q600 в атмосфере аргона со скоростью 10 ° C мин. -1 . Измерения дифракции порошка ex situ проводились на образцах, упакованных в полиимидные трубки в Брукхейвенской национальной лаборатории (BNL), на канале 28-ID (XPD) национального синхротронного источника света II (NSLS-II) с использованием монохроматической длины волны ( λ = 0.19316 Å). 2D дифракционные изображения были собраны на сцинтилляционном детекторе CsI и интегрированы в одномерные изображения в GSAS-II. 31
Электрохимическая характеристика
Электроды были сконструированы с использованием ранее описанного метода. 10 Синтезированный бирнессит калия (K-бирнессит) измельчали в шаровой мельнице SPEX SamplePrep 8000M с α -Bi 2 O 3 (Sigma-Aldrich) и УНТ (Sigma-Aldrich, multi -стенный) в соотношении 60:12:28 по весу (K-бирнессит с Bi 2 O 3 ).Электроды без Bi 2 O 3 были сконструированы с соотношением K-бирнессит / УНТ 60:40 (K-бирнессит). Все сконструированные электроды сохраняли высокую емкость 22 мАч см -2 . После смешивания к порошку композита добавляли политетрафторэтилен (PTFE, Sigma-Aldrich, 60 мас.% В H 2 O), так что PTFE составлял 2,5 мас.% От полученного композита. К сухому композиту добавляли дополнительную воду для создания суспензии, а затем заливали на сетку из никеля. Электроды сушили при 60 ° C в течение 12 часов, а затем прессовали перед сборкой батареи.Батареи были собраны в полипропиленовой коробке с противоэлектродами Ni (OH) 2 (Jiansu Highstar Battery Manufacturing Co Ltd., FP27 +) и электродом сравнения Hg / HgO (Pine Research) с 9 M KOH электролитом. Все батареи выдерживали 12 ч перед электрохимическим тестированием. Для поддержания давления в дымовой трубе на протяжении всего испытания использовались тефлоновые прокладки. Электрохимические испытания проводили на тестере батарей Arbin Instruments в диапазоне напряжений от -1,0 до 0,3 В относительно Hg / HgO. Все доли углерода были рассчитаны на основе теоретической емкости K-бирнессита в исходном состоянии (K 0.22 MnO 2 0,26 H 2 O, 476 мАч г -1 , 1,78 электронного эквивалента). Циклическую вольтамперометрию выполняли на многоканальном потенциостате BioLogic в том же диапазоне напряжений со скоростью развертки 0,1 мВ с -1 .
Дифракция операндов
Энергодисперсионные дифракционные измерения операндов (EDXRD) были выполнены на канале 6-BM передового источника фотонов (APS) Аргоннской национальной лаборатории (ANL). 32,33 Излучение белого луча использовалось для проникновения в корпус ячейки без дополнительных окон или изменений в конструкции ячейки.Измерительный объем пучка составлял 2 × 4 × 0,05 мм, при этом основная внутренняя часть электродов была профилирована с пространственным разрешением 0,05 мм вдоль направления тока. Эти ячейки циклически перемещались в пучке со скоростью C / 3, при этом картины дифракции рентгеновских лучей собирались под двумя разными углами с использованием германиевого детектора. Угол детектора 2,5 ° и 1,5 ° покрывает диапазон расстояний d от 2 до 8 Å, как показано на дополнительном рис. 1 (доступно на сайте stacks.iop.org/JES/167/110514/mmedia) при высоком уровне сигнала Качество выше 7 Å было критическим при измерении отражения бирнессита (002).На дополнительном рис.1 области, где затухание было высоким при более низких энергиях фотонов и области низкого отношения сигнал / шум при более высоких энергиях, показаны в зависимости от угла детектора, причем интересующие углы показаны звездочками и соответствующими 2 θ Cu Значения Kα соответствуют обычным лабораторным приборам.
Operando спектроскопия
Operando Измерения рентгеновской абсорбционной спектроскопии (XAS) были выполнены на канале NSLS-II 7-BM (QAS). Батареи были сделаны аналогичной конструкции, за исключением 0.Окно PEEK толщиной 01 дюйм было добавлено к конструкции ячейки и циклически проверено на C / 3. Это позволило провести измерения флуоресценции на Bi L III -краю (13419 эВ) и Mn K-краю (6539 эВ) во время цикла клеток. Все измерения XAS были объединены, выровнены и нормализованы в Athena. 34 Теоретические модели Bi 2 O 3 и Bi 0 были созданы в Artemis расчетами FEFF6 для сравнения разряженной и заряженной области края Bi L III в R-пространстве с k-диапазоном 2–10 Å −1 в k 2 k -весов одновременно с dk = 2. 35,36 Линейная комбинационная аппроксимация (LCF) рентгеновской абсорбционной спектроскопии вблизи края (XANES) также была проведена в Афине, где Bi 0 и Bi 2 O 3 использовались в качестве стандартов для Bi L III Кромочная подгонка и чистый K-бирнессит и MnO использовались для подгонки K-кромки Mn. Рамановские спектроскопические измерения Operando проводили с помощью Thermo Fisher DXR2xi с лазером 455 нм при мощности 2 мВт с использованием испытательной ячейки EL-Cell ECC-Opta-Std с кварцевым окном.Соответствующие K-бирнессит и K-бирнессит с электродами из Bi 2 O 3 были приготовлены на никелевой сетке, с сепаратором из стекловолокна и анодом Ni (OH) 2 и 9 M KOH электролитом. Тесты проводились со скоростью C / 2, при которой спектры собирались во время зарядки.
Синтез бирнессита хорошо известен в литературе. 30 Однако существует значительное расхождение в классификации основной структуры с синтетическими образцами, демонстрирующими структуры орторомбического, моноклинного и гексагонального типов. 37–41 Многие связывают это с разнообразием сверхструктур, в которых слои [MnO 6 ] могут демонстрировать различную ориентацию упаковки и вакансии Mn, влияющие на симметрию. Кроме того, интеркалирующие катионы и нейтральные частицы, включая H 2 O, могут вставляться в широкий диапазон интерстициальных мест в родительских структурах, которые все еще считаются бирнесситом. Эти фазы бирнессита также показали свою динамику в кислых и основных условиях, где присутствие низких концентраций Mn 2+ может впоследствии образовывать фазы Mn 3 O 4 или фазы MnOOH из-за перегруппировки и диффузии Mn в кристаллической решетке. . 42,43 Следовательно, вероятны динамические фазовые изменения, происходящие в электролите с pH = 16 в этой аккумуляторной системе, создающие структурные вариации при сравнении сухого, изолированного, синтезированного бирнессита и материала электрода, насыщенного КОН. Для следующих исследований синтезированный изолированный бирнессит может быть классифицирован как имеющий высокую степень кристалличности с заявленной гексагональной симметрией P6 3 / mmc, как показано на рис. 1. 40,44 Межслоевое расстояние d по отражению (002) — 7.131 Å, который содержит слои [MnO 6 ]. Отражение (004) содержит промежуточный слой, состоящий из H 2 O и K + , которые могут занимать одни и те же кристаллографические позиции. Было обнаружено, что полученный синтезированный бирнессит имеет содержание K / Mn 0,22 на основе степени окисления Mn, определенной с помощью анализа XANES (дополнительный рисунок 2), с содержанием воды 0,26 молярных эквивалентов на основе анализа ТГА (дополнительный рисунок 3) , полученная химическая формула, K 0,22 MnO 2 0.26 H 2 O. 45 Уточнение по Ритвельду синтезированного материала с использованием этих содержаний K и H 2 O показывает хорошее согласие с наблюдаемой картиной, как показано на дополнительном рисунке 4 с соответствующими параметрами в Дополнительная таблица 1.
Приблизить Уменьшить Сбросить размер изображения
Рис. 1. Рентгенограмма от синтезированного K-бирнессита по сравнению с теоретическими отражениями.На вставке показана элементарная ячейка гексагонального бирнессита вдоль оси b с октаэдрами Mn (серый), кислородом (синий), смешанным межслоевым заполнением калия (желтый) и кислородом (синий), представляющим межслоевую воду.
Загрузить рисунок:
Стандартное изображение Изображение высокого разрешенияЭлектрохимическое поведение этого материала в 9 М КОН с добавкой Bi 2 O 3 показано на рис. 2а. Без Bi 2 O 3 есть два потенциальных плато во время разряда при -0.33 В по сравнению с Hg / HgO, достигая 211 мАч г -1 , затем снижаясь до другого плато между -0,8 и -1 В, что обеспечивает еще 123 мАч г -1 емкости (334 мАч г -1 , 1,24 электрона эквиваленты всего). После заряда возникает одно плато при -0,25 В относительно Hg / HgO и простирается до 193 мАч g -1 (0,72 электронного эквивалента), пока не достигнет верхнего предела напряжения. Хотя начальный разряд показывает более 1 электронного эквивалента, он не является обратимым в процессе заряда.В CV K-бирнессита, показанном на рис. 2b, первый пик восстановления при -0,42 В относительно Hg / HgO наблюдается с меньшим вторым пиком при -0,87 В, что хорошо соответствует профилю напряжения. Основной пик окисления находится при -0,15 В, а другой пик меньшего размера наблюдается при 0,17 В, что указывает на то, что другой окислительно-восстановительный процесс происходит при высоком потенциале, даже несмотря на то, что профиль напряжения не указывает на какое-либо очевидное плато в этой области. Во втором и третьем циклах CV наблюдается значительная поляризация (−0.Сдвиг на 1 В в третьем цикле) с уменьшенным током, указывающим на снижение мощности.
Приблизить Уменьшить Сбросить размер изображения
Рис. 2. (a) Профили напряжения для гальваностатического разряда и заряда при C / 3 K-бирнессита и K-бирнессита с Bi 2 O 3 (22 мАч см -2 ). С соответствующей циклической вольтамперометрией для трех циклов K-бирнессита (b) и K-бирнессита с Bi 2 O 3 (c).
Загрузить рисунок:
Стандартное изображение Изображение высокого разрешенияПри добавлении в электрод Bi 2 O 3 профиль напряжения резко меняется, расширяясь до более высоких емкостей и достигая лучшей обратимости при зарядке (рис. 2a). Начальное плато разряда находится при -0,39 В и простирается до 373 мАч g -1 (1,39 электронного эквивалента), что превышает общую разрядную емкость K-бирнессита. Еще одно плато при -0.6 В, что составляет 437 мАч g -1 (1,62 электронных эквивалента), что составляет 91% от общей емкости, ожидаемой от K 0,22 MnO 2 0,26 H 2 O. Это полностью обратимо при зарядке с тремя соответствующими плато при -0,47, -0,25 и 0,05 В, достигая 457 мАч г -1 (1,71 электронного эквивалента). Это немного выше разрядной емкости, которая будет обсуждаться далее при анализе операций. CV, рис. 2c, показывает начало первого пика восстановления при -0.27 В с пиком при -0,55 В и вторым плато восстановления при -0,69 В. Пики окисления находятся при -0,42, -0,1 и 0,26 В, что указывает на то, что наибольший потребляемый ток находится между -0,1–0,26 В, что соответствует происходит только после второго плато в профиле напряжения. Это говорит о том, что обратимый процесс окисления происходит выше -0,25 В после второго плато напряжения в профиле напряжения. После первого цикла наблюдается значительный сдвиг пика, при котором основной вклад в плотность тока составляет -0.7 В при восстановлении, и второе плато окисления сдвигается до 0,09 В, разница в 0,2 В от первого цикла и третий пик окисления больше не наблюдается.
Для корреляции электрохимического отклика на структурные изменения во время первого цикла контролировали действие XANES как Mn K-края, так и Bi L III -края. Выровненный и нормализованный Mn K-край XANES для K-бирнессита показан на дополнительном рис. 5, а K-бирнессит с электродом из Bi 2 O 3 , дополнительный рис.6. XANES с ребром Bi L III для K-бирнессита с Bi 2 O 3 также показан на дополнительном рис. 7. Линейный комбинированный фитинг (LCF) был использован для дальнейшего количественного определения степеней окисления для обоих Mn. и Би. Для электрода, содержащего K-бирнессит, степень окисления Mn в ячейке была ниже +3,78, что показывает, что он был более восстановленным по сравнению с исходным порошковым стандартом. Это может быть из-за некоторого саморазряда, происходящего во время 12-часовой стадии покоя, или из-за того, что бирнессит медленно интеркалирует K + из электролита, это будет обсуждаться дополнительно в данных дифракции операндо, а также было отмечено ранее в MnO 2 щелочные электролиты, содержащие Bi 2 O 3 . 8 При разрядке степень окисления снижается во время первого плато до +2,79 (рис. 3a), что является линейным уменьшением по сравнению с теоретической скоростью восстановления, как показано на дополнительном рис. 8. Это линейное поведение продолжается до конца. разряда с конечной степенью окисления +2,47. Это общее изменение степени окисления на +1,31 электронного эквивалента, которое хорошо коррелирует с электрохимическим откликом.
Приблизить Уменьшить Сбросить размер изображения
Рисунок 3. Профиль напряжения батареи циклически изменялся при C / 3 во время измерений XANES со степенью окисления, определенной путем линейной комбинации Mn и Bi K-бирнессита (a) и K-бирнессита с Bi 2 O 3 (b).
Загрузить рисунок:
Стандартное изображение Изображение высокого разрешенияПри зарядке наблюдается только полное изменение степени окисления на +0,4 электронного эквивалента, которое не учитывает всю емкость, наблюдаемую в электрохимическом отклике.Это происходит из-за накопления электрохимически инертной фазы шпинели Mn 3 2.667+ O 4 фазы шпинели во время разряда, что подтверждают как дифракционные, так и спектроскопические данные в этой рукописи. Эта шпинель первоначально образуется в разряде и не является обратимой, а ее повышенная степень окисления +2,667 препятствует полному восстановлению Mn до гидроксида Mn 2+ . 25 После загрузки часть преобразованного Mn 2+ в фазе Mn (OH) 2 начнет превращаться в Mn 3+ , однако Mn 3 O 4 все еще инертен и, следовательно, мы не наблюдаем каких-либо серьезных изменений в степени окисления после первоначального превращения материалов Mn (OH) 2 .На рис. 3а этот переход фиксируется изменением степени окисления, наблюдаемым в течение первых 30 мин заряда. Примерно через 1 час степень окисления показывает минимальные изменения до последних 20 минут заряда, где наблюдается еще одно небольшое увеличение. В той области, где происходит минимальное изменение степени окисления, средняя степень окисления составляет +2,8, что близко к +2,667, ожидаемому для фазы шпинели. Дополнительные свидетельства дифракции и спектроскопии комбинационного рассеяния показывают, что фаза шпинели продолжает формироваться при заряде, что подтверждает несоответствие в изменении состояния окисления.
Для K-бирнессита с электродом из Bi 2 O 3 , рис. 3b, наблюдается линейная тенденция со степенью окисления Mn и скоростью разряда, как показано на дополнительном рис. 8. Общее изменение степени окисления Mn составляет Передано 1,69 электрона, что составляет наблюдаемую электрохимическую емкость. Существует также значительный окислительно-восстановительный потенциал Bi, возникающий ниже -0,65 В по сравнению с HgHgO, где самая низкая наблюдаемая степень окисления Bi, равная 1,5 электронным эквивалентам, происходит через 2 минуты после заряда. Это подтверждает, что Bi 2 O 3 электрохимически активен в этом окне напряжения и способствует увеличению емкости.На этапе зарядки плато при -0,42 В происходит от окислительно-восстановительного потенциала Bi, где нет изменений в степени окисления Mn. На втором плато окислительно-восстановительный потенциал Bi замедляется при средней степени окисления +2,65. Это будет обсуждаться далее в дифракционном анализе, поскольку гидратированные частицы Bi 3+ и твердый Bi 2 O 3 присутствуют во время фазового перехода от Bi 0 к Bi 2 O 3 . 46–48 Во время второго плато общее изменение степени окисления Bi составляет примерно +0.1, в то время как окислительно-восстановительный потенциал Mn также увеличивается только до степени окисления +2,10. Таким образом, на втором плато присутствуют два окислительно-восстановительных материала с незначительной окислительно-восстановительной активностью Mn. Это указывает на то, что большая часть начального внедрения в прослойку Mn (OH) 2 представляет собой нейтральные частицы, такие как H 2 O. При дальнейшей загрузке степень окисления Mn быстро увеличивается до +2,8, а затем постепенно увеличивается до +3,39 на втором плато. Это составляет общую окислительно-восстановительную активность Mn 1,4 электронных эквивалентов (374 мАч г -1 ) и окислительно-восстановительного потенциала Bi 1.5 электронных эквивалентов (общий вклад 75 мАч г -1 ), что соответствует наблюдаемой емкости 457 мАч г -1 . Анализ XANES также показывает, что K-бирнессит не перезаряжается до такой высокой степени, как исходная степень окисления. Поскольку никакие дополнительные фазы не были идентифицированы в соответствующих измерениях дифракции или рамановской спектроскопии, это связано с более высоким зарядом межузельных ионов в перезаряженной фазе бирнессита. Это снижение окислительно-восстановительного поведения компенсируется добавлением окислительно-восстановительного потенциала Bi.Более того, обратимость этого композитного электрода сильно зависит как от окислительно-восстановительной активности Bi, так и от ионов, находящихся в промежуточном слое перезаряженной фазы бирнессита.
Для дальнейшего изучения механизма реакции были выполнены измерения дифракции рентгеновских лучей с дисперсией по энергии (EDXRD). Дифракционные данные были собраны на электроде 2 × 4 × с калибровочным объемом 0,05 мм, где можно было исследовать различные пространственные положения электрода во время работы батареи.Дополнительное видео 1 (доступно на сайте stacks.iop.org/JES/167/110514/mmedia) демонстрирует K-бирнессит с разряжением и зарядом электрода Bi 2 O 3 с изменением дифракционных пиков в зависимости от глубины электрода. На протяжении этих сканирований фазы K-бирнессита, Mn (OH) 2 , Bi 2 O 3 и Bi 0 контролировались во времени и в пространстве. Бирнессит может быть проиндексирован по гексагональной симметрии P6 3 / mmc, обсужденной ранее, Mn (OH) 2 проиндексирован по симметрии P-3m1, α-Bi 2 O 3 (P21 / c) и Bi 0 с ромбоэдрической пространственной группой R-3m.Дополнительные рис. 9 и 10 показывают, что относительные пиковые интенсивности отражений наивысшей интенсивности относительно однородны по всему электроду в течение первого цикла. Таким образом, сканирование в центре K-бирнессита и K-бирнессита с электродами из Bi 2 O 3 представляет реакции по всему электроду и показано на рис. 4, где K-бирнессит (002) , Mn 3 O 4 (101) и Mn (OH) 2 (001) выделены.На рис. 4а показано, что K x MnO 2 (002) находится на расстоянии d 7,136 Å, как и у чистого порошка. Однако перед подачей любого тока преобладает пик Mn 3 O 4 (101), указывающий на то, что во время начального покоя в электролите происходило образование фазы шпинели. Во время первоначального остатка калиевого бирнессита может происходить миграция Mn 3+ , находящегося в координации MnO 6 бирнессита, в промежуточный слой 44 вместе с саморазрядом, что приводит к уменьшению Mn 3 O 4 фаза .Предыдущие исследования показывают, что диспропорционирование Mn 3+ → Mn 4+ + Mn 2+ также будет происходить в материалах батарей MnO 2 , обеспечивая источник Mn 2+ в образовании шпинели. 49,50 Во время разряда наблюдается дальнейшее сжатие бирнессита (002) до примерно 50% DOD (1,1 электронного эквивалента) без наблюдаемого Mn (OH) 2 до тех пор, пока не будет достигнуто второе более низкое плато потенциала. Интенсивность рефлекса Mn 3 O 4 (101) также увеличивается вдоль первого плато.При зарядке фаза Mn 3 O 4 сохраняется, интенсивность Mn (OH) 2 постепенно уменьшается, а бирнессит (002) лишь немного снова появляется на самом верху заряда с основным уширением пика. В течение первого цикла образуется необратимый Mn 3 O 4 , который сохраняется на протяжении всего цикла. Хотя образуется необратимая фаза, все еще происходит частичное преобразование между K-бирнесситом и Mn (OH) 2 , но преобразование бирнессита ограничено очень высокими потенциалами и не полностью переходит в кристаллическое состояние.
Приблизить Уменьшить Сбросить размер изображения
Рис. 4. Образцы EDXRD циклических батарей в C / 3. К-бирнессит (а) и К-бирнессит с Bi 2 O 3 (б) при углах детектора 1,5 °. Отмечены рефлексы K x MnO 2 (002), Mn 3 O 4 (101) и Mn (OH) 2 (001). Красная, синяя и фиолетовая точки на кривой напряжения коррелируют картины дифракции со временем, собранным в профиле напряжения.Серые прямоугольники представляют пики флуоресценции Bi.
Загрузить рисунок:
Стандартное изображение Изображение высокого разрешенияДобавление Bi 2 O 3 подавляет образование фазы Mn 3 O 4 , как показано на фиг. 4b. Хотя возможно, что имеется незначительное отражение Mn 3 O 4 (101) в электроде, содержащем Bi 2 O 3 , дальнейший высокоугловой EDXRD не показывает никаких других наблюдаемых Mn 3 O 4 отражений, и спектроскопия комбинационного рассеяния света не обнаружила наличия этой фазы во время заряда.Новые пики, классифицируемые как флуоресценция Bi, показаны в серых прямоугольниках (рис. 4b) и появляются из-за диапазона энергий, используемого для сбора дифракционных картин. Первоначально отражение бирнессита (002) составляет 7,157 Å, что свидетельствует о значительном расширении кристаллической решетки по сравнению с исходным материалом. Ранее было показано, что такое набухание решетки указывает на поглощение Tl + , Zn 2+ , Cu 2+ и Pb 2+ в промежуточном слое и может предполагать ионный обмен между K + и Bi 3. + . 51–54 На основании предыдущих исследований прослои бирнессита являются динамическими и будут поглощать H 2 O, ионы и органические молекулы из раствора и, следовательно, могут быть чувствительны к ионам в электролите и расширяться из-за гидратации. 55–57 Мы постулируем, что без присутствия Bi 2 O 3 Mn 2+ образуется в результате диспропорционирования и приводит к образованию Mn 3 O 4 . Следовательно, поскольку мы видим расширение решетки в присутствии Bi 2 O 3 , мы предполагаем, что некоторое количество Bi 3+ было включено в K-бирнессит и, следовательно, предотвратило диспропорционирование до Mn 2+ и разрушение структуры. .Во время разряда сжатие бирнессита (002) происходит вдоль первого плато, затем при глубине разряда 12,5% (0,38 электронного эквивалента) образуется Mn (OH) 2 (рис. 5a), что указывает на двухфазное поведение между K-бирнесситом. и материал Mn (OH) 2 без промежуточных фаз. В конце разряда присутствует только Mn (OH) 2 , интенсивность которого уменьшается при заряде. Интенсивность отражения бирнессита (002) не возвращается до третьего плато, где наблюдается четкое образование без кристаллических промежуточных фаз.
Приблизить Уменьшить Сбросить размер изображения
Рис. 5. Сравнение пиковой интенсивности между бирнесситом и Mn (OH) 2 (a) и вариациями межслоевого расстояния бирнессита (b) в зависимости от глубины разряда.
Загрузить рисунок:
Стандартное изображение Изображение высокого разрешенияПри более подробном изучении перехода бирнессита, начальная реакция включает быстрое сокращение промежуточного слоя примерно до 12.5% глубина разряда (DOD). Рисунок 5b показывает, что обе прослойки бирнессита быстро уменьшаются до <7 Å, а затем переходят к более медленной скорости сжатия. В это время происходит превращение бирнессита в фазу Mn (OH) 2 в электродах, содержащих Bi 2 O 3 . В случаях без Bi 2 O 3 образование шпинели увеличивается. Межслоевое расстояние для электрода из K-бирнессита достигает минимально обнаруживаемого сжатия 6,983 Å, в то время как электрод, содержащий Bi 2 O 3 , сокращается до 6.Минимум 934 Å. Эти вариации межслоевого расстояния при разряде свидетельствуют о кардинально ином составе межслоевого слоя, при этом можно было предположить, что некоторые ионы Bi 3+ находятся внутри прослойки, вызывая дополнительное сжатие по сравнению с водой и промежуточными составами K + , которые выравнивают хорошо с недавними расчетами DFT. 19 Рисунок 5a показывает, что, хотя уменьшение интенсивности бирнессита кажется линейным для обоих электродных условий, электрод без Bi 2 O 3 уменьшается с ускоренной скоростью и не начинает образовывать Mn (OH) 2 до тех пор, пока не закончится 50% DOD, что объясняется образованием фазы Mn 3 O 4 в качестве промежуточного продукта.При зарядке уменьшение интенсивности Mn (OH) 2 одинаково для обоих электродных условий, но образование бирнессита не происходит до тех пор, пока не достигнет 50% DOD для обоих электродных условий и задерживается дольше для электрода без Bi 2 О 3 . Кроме того, при зарядке электрода, содержащего Bi 2 O 3 , наблюдается расширение решетки, которое указывает на продолжающуюся интеркаляцию катионов в верхней части заряда. Примечательно, что хотя пик K-бирнесситового электрода (002) очень широкий, он имеет значительно большее расстояние между слоями, равное 7.На 188 Å, что на ~ 0,01 Å выше, чем у Bi 2 O 3 , содержащего электроды.
Точное понимание промежуточного слоя является сложной задачей из-за изменчивой природы ионов и нейтральных частиц в электролите во время цикла. Чтобы понять возможные ионы в растворе, мы оценили твердые компоненты электрода, чтобы экстраполировать, какие возможные переходы происходят и как это влияет на различные концентрации ионов в электролите. На рис.6 отражения между d-промежутками 2.2 — 3,6 Å идентифицируются как функция разряда и заряда. Во-первых, наблюдается аналогичное поведение бирнессита (004) при ~ 3,5 Å, что и для рефлексов (002) и второстепенного Mn (OH) 2 . Однако отражения для Bi-содержащих фаз в этом диапазоне d-разнесения дают больше информации о поведении Bi 2 O 3 и Bi 0 . Фаза Bi 2 O 3 является доминирующей на протяжении всего разряда и изменяется только на Bi 0 во время последнего плато, что согласуется с анализом XANES.После зарядки Bi 0 сохраняется на протяжении второго плато заряда, что также согласуется с низкой степенью окисления Bi, наблюдаемой в данных XANES вдоль этого плато. Во время второго плато заряда нульвалентный металлический Bi четко наблюдается в результатах дифракции, но степень окисления> +2,5 по данным XANES. Поэтому мы расширили наш анализ края Bi-Li III на расширенную область тонкой структуры рентгеновских лучей (EXAFS) спектров, чтобы искать доказательства растворенных или гидратированных частиц Bi 3+ .Хотя были наблюдения за переходом твердое тело-твердое тело от металлического висмута к соответствующему оксиду, 58 также были прямые доказательства зависимости pH растворенного Bi (OH) 3 гидратированных ионов и Bi (OH) 4 — при высоком pH в водных растворах, со спектрами XANES 46 , подобными наблюдаемому смещению XANES в этом исследовании. 47,59 Дифракция действительно показывает твердую фазу Bi 0 , но степень окисления можно объяснить только с помощью [Bi (OH) x (H 2 O) y ] 3 − x + растворяется в электролите. 59 В области EXAFS неразряженного, полностью разряженного и полностью заряженного края Bi-Li III (дополнительный рис. 11) показано изменение между Bi 2 O 3 и заряженными частицами с ослаблением Оксид Bi-Bi с амплитудами рассеяния . Межатомные расстояния на дополнительном рис. 11 не исправлены с учетом фазовых сдвигов, но с помощью расчетов FEFF6 для исходных материалов расстояния связи Bi-O первой оболочки коррелируют с 2,07 Å, а оксиды Bi-Bi равны 3.46 и 3,91 Å для α -Bi 2 O 3 . Указанное расстояние связи Bi 0 Bi-Bi составляет 3,11 Å. В неразгруженном материале пути оксидов Bi-Bi аналогичны стандарту α -Bi 2 O 3 . В полностью разряженном состоянии амплитуда Bi-O уменьшается, и наблюдаются расстояния Bi-Bi металл в металлическом состоянии. Хотя Bi 0 является заметной фазой, наблюдаемой при дифракции, все еще наблюдается значительная интенсивность Bi-O, обнаруженная в области EXAFS, что указывает на присутствие оксида висмута в растворе, что объясняет ~ 1.5 степень окисления, наблюдаемая с помощью анализа XANES. Оксиды Bi-Bi проходят путь в полностью заряженном состоянии только частично, что соответствует некоторым ионам Bi 3+ , остающимся в растворе без преобразования кристаллической структуры. Наблюдаемое рассеяние Bi-O как в конце разряда, так и заметное во время зарядки согласуется с расстоянием связи кластера [BiO 3 ], которое прогнозируется для кратных [Bi (OH) x (H 2 O ) n ] 3-m + ионов и α-Bi 2 O 3 . 47,59 Следовательно, результаты EXAFS предполагают, что ионы Bi 3+ в высокой концентрации сосуществуют с твердым Bi 0 в конце разряда и во время заряда.
Приблизить Уменьшить Сбросить размер изображения
Рис. 6. EDXRD-рентгенограммы циклирования K-бирнессита с батареей Bi 2 O 3 при угле детектора 2,5 °. На подграфике показаны отражения Bi 0 , Bi 2 O 3 , Mn (OH) 2 , УНТ и K x MnO 2 .
Загрузить рисунок:
Стандартное изображение Изображение высокого разрешенияПри попытке понять фазовые изменения Mn результаты дифракции ясно показывают образование бирнессита во время третьего плато при зарядке. Однако спектроскопия комбинационного рассеяния может идентифицировать некристаллические фазовые переходы из связывающих колебаний Mn-O / Mn-OH, которые коррелируют с бирнесситом. 60–62 Распространение фазы по рамановской спектроскопии во время заряда показано на рис. 7. К-бирнесситовый электрод имеет пик при 659 см. –1 присутствует (рис.7a – 7c) во время начала заряда и может быть идентифицирована как фаза Mn 3 O 4 . 61 На протяжении всей загрузки это заметная фаза до конца заряда, где основные пики составляют примерно 510, 578 и 635 см. -1 , что соответствует фазе бирнессита. Это хорошо согласуется с ранее обсужденными электрохимическими, XANES и дифракционными результатами, в которых могло произойти изменение фазы / состояния окисления, коррелирующее с бирнесситом. В случае К-бирнессита с Bi 2 O 3 начало образования бирнессита показано на втором плато (рис.7г – 7е). Это отличается от дифракционных наблюдений, которые показывают образование кристаллического бирнессита на третьем плато. Предыдущая литература показывает, что два основных пика ( v 1 и v 2 ) примерно при 578 и 635 см -1 представляют собой участки симметрии A g Mn-O, на которые влияет состав межслоевого слоя. . 29,63 Имеется небольшое смещение пика v 1 с 581,3 до 579,8 см −1 и v 2 с 631.От 9 до 637,7 см -1 , что немного отличается от прослоек K + и H 2 O из предыдущих исследований, которые также могут указывать на другой межузельный ион, такой как Bi 3+ , влияющий на эти колебания. Кроме того, изменение интенсивности v 1 / v 2 коррелировало с H 2 O или K + как преобладающими интерстициальными видами с соотношением> 1,5, указывающим на K + богатые прослои. 29 Отношение наблюдаемых колебаний изменяется во время заряда с 1,45 во время начального формирования на втором плато до 1,72 в конце заряда (третье плато), что предполагает переход от прослойки, богатой H 2 O, к прослойке K + -богатая прослойка. При сравнении заряженного бирнессита с исходным K-бирнесситом с K + и H 2 O в промежуточном слое (дополнительный рис. 12), колебания A g составляют 579 и 634 см −1 с a v 1 / v 2 соотношение 1.6. Учитывая, что синтезированный материал попадает в диапазон перехода заряженного бирнессита, это предполагает, что аналогичная тенденция наблюдается также в K-бирнессите с электродом из Bi 2 O 3 . Бирнессит, образованный без Bi 2 O 3 , имеет v 1 и v 2 при 578,1 и 635,9 см −1 и отношение пиков 1,34, в отличие от бирнессита, образовавшегося в присутствие Bi 2 O 3 и материала после синтеза.
Приблизить Уменьшить Сбросить размер изображения
Рис. 7. Рамановская спектроскопия Operando для электродов с циклическим циклом при C / 2. (а) отдельные спектры комбинационного рассеяния, (б) контурная карта и (в) соответствующий профиль напряжения батареи с K-бирнесситовым электродом. (d) Индивидуальные спектры комбинационного рассеяния, (e) контурная карта и (f) соответствующий профиль напряжения батареи с K-бирнесситом с электродом из Bi 2 O 3 .
Загрузить рисунок:
Стандартное изображение Изображение высокого разрешенияЧтобы получить полное представление о роли Bi 2 O 3 в обратимом образовании фазы бирнессита, необходима стратегия мультимодальной структурной характеристики, чтобы идентифицировать все различные промежуточные соединения, образующиеся во время цикла батареи. Чтобы суммировать основные моменты этих выводов, на рис. 8 схематически показан процесс разряда и заряда. В разряде (рис. 8а, 8б) растворенные ионы Bi 3+ внедряются в прослойку бирнессита, предотвращая диффузию Mn 3+ внутри кристаллической решетки, которая приводит к необратимой фазе Mn 3 O 4 .Анализ XANES показал более низкое содержание фазы бирнессита перед выгрузкой по сравнению с чистым сухим материалом. XANES, наряду с изменением межслоевого расстояния, измеренным с помощью дифракции и идентификации фазы Mn 3 O 4 перед разрядом, показывает основное влияние Bi 2 O 3 на окислительно-восстановительные свойства фаз, содержащих Mn, поддержка вставки Bi 3+ . Ранее также было показано, что Bi 2 O 3 , добавленные к растворам солей Mn 3+ и Mn (OH) 2 в окислительных условиях, также сохраняют более высокую степень окисления с течением времени, поддерживая подавленный саморазряд. . 13 Таким образом, модифицированный Bi бирнессит полностью превращается в фазу Mn (OH) 2 при более высоких потенциалах, чем наблюдалось ранее в щелочной среде, как показывают результаты дифракции. Значительный вклад в емкость вносит преобразование Bi 2 O 3 в Bi 0 , которое является обратимым и преобразуется обратно при зарядке. Хотя окислительно-восстановительная активность как Bi, так и Mn оказывается подавленной во время второго плато напряжения во время заряда (рис. 8c), спектроскопия комбинационного рассеяния определила фазу типа бирнессита, не наблюдаемую при дифракции.Это можно объяснить первоначальным введением нейтрального H 2 O в промежуточный слой с незначительным совместным введением Bi 3+ / K + , что приводит к неупорядоченной некристаллической фазе. Легкое образование этой неупорядоченной фазы бирнессита при низких потенциалах с подавлением Mn 3 O 4 является ключом к обратимому преобразованию бирнессита. Конечный кристаллический бирнессит, который появляется на конечном плато напряжения при заряде, показывает прослойку, которая, вероятно, отражает состав электролита, содержащий H 2 O, K + и Bi 3+ .
Приблизить Уменьшить Сбросить размер изображения
Рис. 8. Схематическое изображение разряда с и без Bi 2 O 3 , присутствующих в электроде, и соответствующий заряд.
Загрузить рисунок:
Стандартное изображение Изображение высокого разрешения17.5 Батареи и топливные элементы — Химия 2e
Задачи обучения
К концу этого раздела вы сможете:
- Опишите электрохимию, связанную с несколькими распространенными батареями
- Отличить топливный элемент от работы аккумулятора
Существует множество технологических продуктов, связанных с исследованиями в области электрохимии за последние два столетия, и ни одна из них не является более очевидной, чем батарея.Батарея — это гальванический элемент, который был специально разработан и сконструирован таким образом, чтобы наилучшим образом соответствовать его предполагаемому использованию в качестве источника электроэнергии для определенных приложений. Среди первых успешных батарей была батарея Daniell , в основе которой лежало самопроизвольное окисление цинка ионами меди (II) (рис. 17.8):
Zn (s) + Cu2 + (водн.) ⟶Zn2 + (водн.) + Cu (s) Zn (s) + Cu2 + (водн.) ⟶Zn2 + (водн.) + Cu (s)Рис. 17.8 Иллюстрация ячейки Даниэля из журнальной публикации 1904 года (слева) вместе с упрощенной иллюстрацией, изображающей электрохимию ячейки (справа).В конструкции 1904 года использовался пористый глиняный горшок, который содержал одно из содержимого полуячейки и служил солевым мостиком к другому полуячейке.
Современные батареи существуют во множестве форм для различных применений, от крошечных кнопочных батарей, обеспечивающих скромные потребности в энергии наручных часов, до очень больших батарей, используемых для резервного питания муниципальных электросетей. Некоторые батареи предназначены для одноразового использования и не могут быть перезаряжены (первичные элементы), в то время как другие основаны на удобных обратимых реакциях элементов, которые позволяют заряжаться от внешнего источника питания (вторичные элементы).В этом разделе будет представлена сводка основных электрохимических аспектов нескольких батарей, знакомых большинству потребителей, и будет представлено соответствующее электрохимическое устройство, называемое топливным элементом , которое может предложить улучшенные характеристики в определенных приложениях.
Ссылка на обучение
Посетите этот сайт, чтобы узнать больше об аккумуляторах.
Одноразовые батареи
Обычная первичная батарея — это сухой элемент, в котором цинковая банка используется как контейнер и анод (клемма «-»), а графитовый стержень — как катод (клемма «+»).Банка с цинком заполнена электролитной пастой, содержащей оксид марганца (IV), хлорид цинка (II), хлорид аммония и воду. Графитовый стержень погружается в электролитную пасту для завершения ячейки. Спонтанная клеточная реакция включает окисление цинка:
анодная реакция: Zn (s) ⟶Zn2 + (aq) + 2e — анодная реакция: Zn (s) ⟶Zn2 + (aq) + 2e−и восстановление марганца (IV)
реакция восстановления: 2MnO2 (s) + 2Nh5Cl (aq) + 2e − ⟶Mn2O3 (s) + 2Nh4 (aq) + h3O (l) + 2Cl — реакция восстановления: 2MnO2 (s) + 2Nh5Cl (aq) + 2e − ⟶Mn2O3 (т) + 2Nh4 (водн.) + h3O (l) + 2Cl−, которые вместе дают клеточную реакцию:
клеточная реакция: 2MnO2 (s) + 2Nh5Cl (aq) + Zn (s) ⟶Zn2 + (aq) + Mn2O3 (s) + 2Nh4 (aq) + h3O (l) + 2Cl − Ecell ~ 1.Реакция 5Vcell: 2MnO2 (s) + 2Nh5Cl (aq) + Zn (s) ⟶Zn2 + (aq) + Mn2O3 (s) + 2Nh4 (aq) + h3O (l) + 2Cl − Ecell ~ 1.5VНапряжение (потенциал ячейки ) сухого элемента составляет примерно 1,5 В. Сухие элементы доступны в различных размерах (например, D, C, AA, AAA). Все размеры сухих элементов состоят из одних и тех же компонентов, поэтому они демонстрируют одинаковое напряжение, но более крупные элементы содержат большее количество окислительно-восстановительных реагентов и, следовательно, способны передавать соответственно большее количество заряда. Как и другие гальванические элементы, сухие элементы могут быть подключены последовательно, чтобы получить батареи с более высоким выходным напряжением, если это необходимо.
Рисунок 17.9 На схематической диаграмме показан типичный сухой элемент.
Ссылка на обучение
Посетите этот сайт, чтобы узнать больше о угольно-цинковых батареях.
Щелочные батареи(рис. 17.10) были разработаны в 1950-х годах для улучшения характеристик сухих элементов, и они были спроектированы на основе тех же пар окислительно-восстановительного потенциала. Как следует из названия, в этих типах батарей используются щелочные электролиты, часто гидроксид калия. Реакции
анод: Zn (s) + 2OH− (aq) ⟶ZnO (s) + h3O (l) + 2e − катод: 2MnO2 (s) + h3O (l) + 2e − ⟶Mn2O3 (s) + 2OH− (водный) ¯cell: Zn (s) + 2MnO2 (s) ⟶ZnO (s) + Mn2O3 (s) Ecell = + 1.43 Ванод: Zn (s) + 2OH− (aq) ⟶ZnO (s) + h3O (l) + 2e − катод: 2MnO2 (s) + h3O (l) + 2e − ⟶Mn2O3 (s) + 2OH− (aq ) ¯cell: Zn (s) + 2MnO2 (s) ⟶ZnO (s) + Mn2O3 (s) Ecell = + 1,43 ВЩелочная батарея может обеспечивать в три-пять раз больше энергии, чем угольно-цинковые сухие элементы аналогичного размера. Щелочные батареи склонны к утечке гидроксида калия, поэтому их следует снимать с устройств для длительного хранения. Некоторые щелочные батареи можно перезаряжать, но большинство — нет. Попытки перезарядить щелочную батарею, которая не является перезаряжаемой, часто приводят к разрыву батареи и утечке электролита гидроксида калия.
Рис. 17.10 Щелочные батареи были разработаны как улучшенная замена угольно-цинковым (сухим) батареям.
Ссылка на обучение
Посетите этот сайт, чтобы узнать больше о щелочных батареях.
Аккумуляторы (вторичные)
Никель-кадмиевые или никель-кадмиевые батареи(рис. 17.11) состоят из никелированного катода, кадмиевого анода и электрода из гидроксида калия. Положительные и отрицательные пластины, которые не могут закоротить сепаратор, скручиваются вместе и помещаются в корпус.Это «желейно-роликовая» конструкция, которая позволяет никель-кадмиевым элементам обеспечивать гораздо больший ток, чем щелочная батарея аналогичного размера. Реакции
анод: Cd (s) + 2OH− (водный) ⟶Cd (OH) 2 (s) + 2e — катод: NiO2 (s) + 2h3O (l) + 2e − ⟶Ni (OH) 2 (s) + 2OH− (aq) ¯cell: Cd (s) + NiO2 (s) + 2h3O (l) ⟶Cd (OH) 2 (s) + Ni (OH) 2 (s) Ecell ~ 1,2 Ванод: Cd (s) + 2OH− (aq) ⟶Cd (OH) 2 (s) + 2e − катод: NiO2 (s) + 2h3O (l) + 2e − ⟶Ni (OH) 2 (s) + 2OH− (aq) ¯cell: Cd (s ) + NiO2 (s) + 2h3O (l) ⟶Cd (OH) 2 (s) + Ni (OH) 2 (s) Ecell ~ 1,2 ВПри правильном обращении никель-кадмиевый аккумулятор можно заряжать около 1000 раз.Кадмий — это токсичный тяжелый металл, поэтому никель-кадмиевые аккумуляторы никогда не следует ломать или сжигать, и их следует утилизировать в соответствии с соответствующими директивами по токсичным отходам.
Рис. 17.11 В никель-кадмиевых батареях используется «желеобразная» конструкция, которая значительно увеличивает ток, который может выдавать батарея, по сравнению с щелочной батареей аналогичного размера.
Ссылка на обучение
Посетите этот сайт для получения дополнительной информации о никель-кадмиевых аккумуляторных батареях.
Литий-ионные батареи(Рисунок 17.12) являются одними из самых популярных аккумуляторных батарей и используются во многих портативных электронных устройствах. Реакции
анод: LiCoO2⇌Li1 − xCoO2 + xLi ++ xe − катод: xLi ++ xe− + xC6⇌xLiC6 ¯ ячейка: LiCoO2 + xC6⇌Li1 − xCoO2 + xLiC6Ecell ~ 3,7 Ванод: LiCoO2⇌Li1 + xCoO ++ xLi1 + xCoO −cathode: xLi ++ xe− + xC6⇌xLiC6¯cell: LiCoO2 + xC6⇌Li1 − xCoO2 + xLiC6Ecell ~ 3,7 ВПеременная стехиометрия реакции клетки приводит к изменению напряжений в ячейках, но для типичных условий x обычно составляет не более 0,5, а напряжение на ячейке составляет примерно 3.Литиевые батареи 7 В. популярны, потому что они могут обеспечивать большой ток, легче, чем сопоставимые батареи других типов, вырабатывают почти постоянное напряжение при разряде и медленно теряют заряд при хранении.
Рис. 17.12 В литий-ионной батарее заряд протекает по мере того, как ионы лития переносятся между анодом и катодом.
Ссылка на обучение
Посетите этот сайт для получения дополнительной информации о литий-ионных батареях.
Свинцово-кислотный аккумулятор (Рисунок 17.13) — это тип аккумуляторной батареи, обычно используемый в автомобилях. Он недорогой и способен производить большой ток, необходимый для автомобильных стартеров. Реакции для свинцово-кислотной батареи —
анод: Pb (s) + HSO4− (aq) ⟶PbSO4 (s) + H + (aq) + 2e − катод: PbO2 (s) + HSO4− (aq) + 3H + (aq) + 2e − −PbSO4 (s) + 2h3O (l) ¯cell: Pb (s) + PbO2 (s) + 2h3SO4 (aq) ⟶2PbSO4 (s) + 2h3O (l) Ecell ~ 2Vanode: Pb (s) + HSO4− (aq) ⟶PbSO4 (s ) + H + (aq) + 2e − катод: PbO2 (s) + HSO4− (aq) + 3H + (aq) + 2e − ⟶PbSO4 (s) + 2h3O (l) ¯cell: Pb (s) + PbO2 (s ) + 2h3SO4 (водн.) ⟶2PbSO4 (s) + 2h3O (l) Ecell ~ 2VКаждая ячейка выдает 2 В, поэтому шесть ячеек соединены последовательно, чтобы получить 12-вольтовый автомобильный аккумулятор.Свинцово-кислотные батареи тяжелые и содержат едкий жидкий электролит, H 2 SO 4 ( водн. ), но часто по-прежнему являются предпочтительными батареями из-за их высокой плотности тока. Поскольку эти батареи содержат значительное количество свинца, их всегда следует утилизировать надлежащим образом.
Рис. 17.13 Свинцово-кислотная аккумуляторная батарея в вашем автомобиле состоит из шести последовательно соединенных ячеек, обеспечивающих 12 В.
Ссылка на обучение
Посетите этот сайт для получения дополнительной информации о свинцово-кислотных аккумуляторах.
Топливные элементы
Топливный элемент — это гальванический элемент, в котором используется традиционное горючее топливо, чаще всего водород или метан, которое непрерывно подается в элемент вместе с окислителем. (Альтернативное, но не очень популярное название топливного элемента — проточная батарея .) Внутри элемента топливо и окислитель подвергаются той же окислительно-восстановительной химии, что и при сгорании, но с помощью каталитического электрохимического соединения, которое значительно более эффективно. . Например, в типичном водородном топливном элементе используются графитовые электроды с катализаторами на основе платины для ускорения двух реакций полуэлемента:
Рисунок 17.14 В этом водородном топливном элементе кислород из воздуха реагирует с водородом, производя воду и электричество.
Анод: 2h3 (g) ⟶4H + (aq) + 4e − Катод: O2 (g) + 4H + (aq) + 4e − ⟶2h3O (g) ¯ Cell: 2h3 (g) + O2 (g) ⟶2h3O (g) Ecell ~ 1,2 ВА Узел: 2h3 (g) ⟶4H + (aq) + 4e − Катод: O2 (g) + 4H + (aq) + 4e − ⟶2h3O (g) ¯ Cell: 2h3 (g) + O2 (g) ⟶2h3O (g) Ecell ~ 1,2 ВЭти типы топливных элементов обычно вырабатывают напряжение около 1,2 В. По сравнению с двигателем внутреннего сгорания, энергоэффективность топливного элемента, использующего ту же окислительно-восстановительную реакцию, обычно более чем в два раза (~ 20% -25% для двигателя по сравнению с ~ 50% –75% для топливного элемента).Водородные топливные элементы обычно используются в расширенных космических миссиях, и были разработаны прототипы для личных транспортных средств, хотя технология остается относительно незрелой.
Ссылка на обучение
Перейдите по этой ссылке, чтобы узнать больше о топливных элементах.
Понимание динамики выделения газов из первичных Zn-MnO2 щелочных батарей с помощью визуализации операндо и датчиков давления (журнальная статья)
Фаэг, Эхсан, Омаста, Трэвис, Халл, Мэтью, Феррин, Шон, Шреста, Суджан, Лехман, Джереми Б., Болинтиняну, Дэн Стефан, Зуроу, Майкл и Мастейн, Уильям Э. Понимание динамики выделения газов из первичной щелочной батареи Zn-MnO2 с помощью визуализации операндо и датчиков давления . США: Н. П., 2018.
Интернет. DOI: 10.1149 / 2.0321811jes.
Фаэг, Эхсан, Омаста, Трэвис, Халл, Мэтью, Феррин, Шон, Шреста, Суджан, Лехман, Джереми Б., Болинтиняну, Дэн Стефан, Зурав, Майкл и Мастейн, Уильям Э. Понимание динамики выделения газов в первичной щелочной батарее Zn-MnO2 с визуализацией операндо и датчиками давления . Соединенные Штаты. https://doi.org/10.1149/2.0321811jes
Фаэг, Эхсан, Омаста, Трэвис, Халл, Мэтью, Феррин, Шон, Шреста, Суджан, Лехман, Джереми Б., Болинтиняну, Дэн Стефан, Зурав, Майкл и Мастейн, Уильям Э. Ту.
«Понимание динамики выделения газа в первичной щелочной батарее Zn-MnO2 с помощью операндо-визуализации и датчиков давления».Соединенные Штаты. https://doi.org/10.1149/2.0321811jes. https://www.osti.gov/servlets/purl/1529287.
@article {osti_1529287,
title = {Понимание динамики выделения газов из первичной щелочной батареи Zn-MnO2 с помощью визуализации операндо и датчиков давления},
автор = {Фаэг, Эхсан и Омаста, Трэвис и Халл, Мэтью и Феррин, Шон и Шреста, Судан и Лехман, Джереми Б.и Болинтиняну, Дэн Стефан и Зурав, Майкл и Мастейн, Уильям Э.},
abstractNote = {Основной причиной разрыва защитного вентиляционного отверстия в щелочных батареях является внутренняя нестабильность Zn в сильно щелочной среде. Zn и водный KOH взаимодействуют паразитно с образованием газообразного водорода, который может разрушить уплотнение и выбросить водород вместе с небольшими количествами электролита и, таким образом, повредить потребительские устройства. Известно, что жестокие условия, особенно глубокая разрядка, ускоряют это «газообразование».Чтобы понять основные движущие силы и механизмы такого газообразования, были объединены результаты мультифизического моделирования, микроскопии ex-situ и оперативных измерений клеточного потенциала, давления и визуализации.









 Все показатели фиксировались в специальной таблице.
Все показатели фиксировались в специальной таблице.




 Навигатор, фонарь — всё это должно работать без проблем.
Навигатор, фонарь — всё это должно работать без проблем. wikipedia.org/wiki/Bateria_ogniw
wikipedia.org/wiki/Bateria_ogniw